Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
71) O odor do peixe é causado pela presença de aminas provenientes da degradação de algumas proteínas. Uma das aminas é a metilamina que, em solução aquosa, apresenta o seguinte equilíbrio:
- A) A metilamina é um ácido de Brönsted.
- B) A metilamina é um ácido de Lewis.
- C) A adição de limão desloca o equilíbrio para a esquerda.
- D) A adição de vinagre desloca o equilíbrio para a direita.
FAZER COMENTÁRIO- E) A adição de hidróxido de sódio desloca o equilíbrio para a direita.
A alternativa correta é letra D
A metilamina é uma base de Brönsted-Lowry. A adição de qualquer ácido nesta reação, neutralizaria o OH- que está sendo formado, deslocando assim o equilíbrio para a direita, visando repor o OH- neutralizado.72) A reação da amônia com a água é representada na equação:
- A) I, II e III.
- B) I e II, apenas.
- C) I e III, apenas.
- D) II e III, apenas.
FAZER COMENTÁRIO- E) III, apenas.
A alternativa correta é letra D
A assertiva I está incorreta. Observando os dados da constante de equilíbrio a 5 e a 25 °C, nota-se que a constante de equilíbrio aumentou com o aumento da temperatura. Logo, a reação química é classificada como endotérmica. A assertiva II está correta. O aumento de temperatura favorece a reação endotérmica, ou seja, desloca o equilíbrio no sentido de formação dos produtos (desloca para direita), aumentando a concentração dos íons amônio e hidroxila. A assertiva III também está correta. A adição de íons amônio faz com que se aumente a concentração deste, perturbando o equilíbrio, de modo que se desloque no sentido de consumo destes íons e de íons hidroxila, para formação de amônia e água (desloca para esquerda), tonando o meio menos básico. Estão coerentes as assertivas II e III, portanto, a resposta correta é a alternativa D.73) O monóxido de nitrogênio é um dos poluentes atmosféricos lançados no ar pelos veículos com motores mal regulados. No cilindro de um motor de explosão interna de alta compressão, a temperatura durante a combustão do combustível com excesso de ar é da ordem de 2400 K e os gases de descarga estão ao redor de 1200 K. O gráfico representa a variação da constante de equilíbrio (escala logarítmic
- A) em função da temperatura, para a reação de formação do NO, dada por
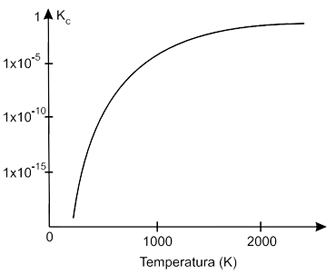 Considere as seguintes afirmações:I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em N2 e O2 II. O aumento da pressão favorece a formação do NO.III. A 2400 K há maior quantidade de NO do que a 1200 K.IV. A reação de formação do NO é endotérmica.São corretas as afirmações contidas somente em FAZER COMENTÁRIO
Considere as seguintes afirmações:I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em N2 e O2 II. O aumento da pressão favorece a formação do NO.III. A 2400 K há maior quantidade de NO do que a 1200 K.IV. A reação de formação do NO é endotérmica.São corretas as afirmações contidas somente em FAZER COMENTÁRIOA alternativa correta é letra E
I) Errada - A adição de catalisadores influencia apenas na velocidade da reação e nao no deslocamento do equílibrio, logo é falsa.II) Errada - A reação que ocorre é N2 + O2 <--> 2NOcomo o aumento da pressão desloca a reação para o lado onde há menor número de mol de gás, o equilíbrio não será deslocado por aumento de pressão pois o número de mols de gás é igual nos produtos e reagentes.III) Correta - À 2400K a constante de equílibrio é maior do que à 1200K, o que significa que a reação direta é mais favorecida, ou seja, a reação de formação de NO, portanto é verdadeira.IV) Correta - Como a constante de equílibrio é maior com o aumento da temperatura, nota-se que a reação de formação de NO é favorecida proporcionalmente à quantidade de calor fornecida, logo é Endotérmica.74) O equilíbrio ácido básico do sangue pode ser representado como segue: CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3- Assinale a alternativa que apresente dois fatores que combateriam a alcalose respiratória (aumento do pH sanguíneo).
FAZER COMENTÁRIO- A) Aumento da concentração de CO2 e HCO3–.
- B) Diminuição da concentração de CO2 e HCO3–.
- C) Diminuição da concentração de CO2 e aumento da concentração de HCO3–.
- D) Aumento da concentração de CO2 e diminuição da concentração de HCO3– .
- E) Aumento da concentração de CO2 e diminuição da concentração de H2O.
A alternativa correta é letra D
Para combater a alcalose (aumento do pH do sangue) o equílibrio deve ser deslocado para a direita, com a formação de H+. Deve-se portanto diminuir a concentração dos produtos e aumentar a concentração dos reagentes. Isso é representado na alternativa D.Questão 75
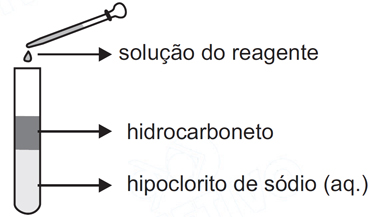 À medida que o gás cloro é formado pela perturbação do seguinte equilíbrio na fase aquosaCl– + ClO– + H2O → Cl2 + 2OH–, a fase que contém o hidrocarboneto vai adquirindo a coloração esverdeada típica deste halogênio. Considerando que a cada um dos cinco frascos contendo quantidades idênticas da mesma solução de hipoclorito de sódio e de hidrocarboneto líquido, foi adicionada uma das seguintes soluções: cloreto de sódio, hidróxido de sódio, ácido acético, ácido clorídrico e nitrato de amônio, todas com as mesmas concentrações molares, haverá a maior produção de gás cloro no tubo ao qual foi adicionado a solução deFAZER COMENTÁRIO
À medida que o gás cloro é formado pela perturbação do seguinte equilíbrio na fase aquosaCl– + ClO– + H2O → Cl2 + 2OH–, a fase que contém o hidrocarboneto vai adquirindo a coloração esverdeada típica deste halogênio. Considerando que a cada um dos cinco frascos contendo quantidades idênticas da mesma solução de hipoclorito de sódio e de hidrocarboneto líquido, foi adicionada uma das seguintes soluções: cloreto de sódio, hidróxido de sódio, ácido acético, ácido clorídrico e nitrato de amônio, todas com as mesmas concentrações molares, haverá a maior produção de gás cloro no tubo ao qual foi adicionado a solução deFAZER COMENTÁRIO- A) cloreto de sódio.
- B) hidróxido de sódio.
- C) ácido acético.
- D) ácido clorídrico.
- E) nitrato de amônio.
A alternativa correta é letra D
A questão trata do deslocamento de equílibrio pela adição ou consumo de substâncias envolvidas. Para resolvê-la é necessário compreender o princípio de Le Chatelier para este caso, ou seja, que se há aumento de certa substância no equílibrio, o equilíbrio é deslocado no sentido de consumir esta substância e se certa substância do equílibrio é consumida por alguma substância adicionada, o equílibrio é deslocado no sentido de produzir esta substância que foi consumida.Dentre as substâncias fornecidas, aquelas que oferecem grandes quantidades de cloreto, deslocando o equilíbrio para a direita e formando Cl2, são o cloreto de sódio e o ácido clorídrico. A quantidade de cloreto fornecida é semelhante para as duas substâncias, entretanto, o HCl dá uma contribuição extra, pois ao ionizar-se libera H+, que reage com o OH- formando água, ou seja, diminui-se a concentração de OH- favorecendo ainda mais a produção de Cl276) Para gaseificar um refrigerante, injeta-se gás carbônico sob pressão. Parte do gás injetado dissolve-se na solução que constitui o refrigerante, de modo que, ao ser fechada a garrafa, estabelecem-se, entre outros, os seguintes equilíbrios químicos simultâneos:
- A) I
- B) II
- C) III
- D) I e II
FAZER COMENTÁRIO- E) II e III
A alternativa correta é letra B
A assertiva I é incorreta. A pressão em uma cidade litorânea, que se encontra no nível do mar (1 atm) é maior que em uma cidade montanhosa, onde a pressão é menor que 1 atm. Logo, o escape será menos intenso, porque terá maior pressão na garrafa aberta, dificultando a saída do gás carbônico (CO2). A assertiva II é correta. Sabe-se que o limão é ácido, pois uma das propriedades organolépticas para classificação deste alimento é o sabor azedo. Como a substância ácida tem na sua composição íons H+, ao adicionar o suco do limão ao refrigerante, aumenta-se a concentração de íons H+ e o equilíbrio será deslocado para a esquerda no sentido de formação do gás carbônico (vide equação de reação, aumentando seu escape do refrigerante). Por fim, a assertiva III também é incorreta. Ao adicionar mais água à solução aquosa do refrigerante o equilíbrio químico será deslocado para a direita, no sentido de minimizar a pertubação do sistema, consumindo gás carbônico para formação de H2CO3(aq), diminuindo o escape do CO2. Está coerente apenas a assertiva II, portanto, a resposta correta é a alternativa B.Questão 77
nautilus.fis.uc.pt/spf/DTE/pdfs/fisica_quimica_a_11_homol.pdf, acesso em 28.09.2012Considere a reação de formação da amônia N2(g)+3H2(g)⇔2NH3(g) e o gráfico, que mostra a influência conjunta da pressão e da temperatura no seu rendimento.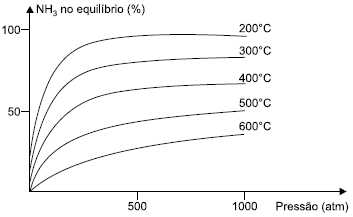 FELTRE, Ricardo. Química – vol. 2. São Paulo, Editora Moderna, 2004
FELTRE, Ricardo. Química – vol. 2. São Paulo, Editora Moderna, 2004
A análise do gráfico permite concluir, corretamente, que:FAZER COMENTÁRIO- A) a reação de formação da amônia é endotérmica.
- B) o rendimento da reação, a 300 atm, é maior a 600 °C.
- C) a constante de equilíbrio (KC) não depende da temperatura.
- D) a constante de equilíbrio (KC) é maior a 400 °C do que a 500 °C.
- E) a reação de formação da amônia é favorecida pela diminuição da pressão.
A alternativa correta é letra D
Pelo gráfico, observa-se que a diminuição da temperatura aumenta o rendimento da reação, portanto, a reação direta é exotérmica e a constante de equilíbrio (KC) é maior à 400 °C do que a 500 °C. A reação de formação da amônia é favorecida pelo aumento da pressão, pois desloca o equilíbrio químico no sentido de contração de volume.
E também, o rendimento da reação a 300 atm é maior à 200 °C. Portanto, a resposta correta é a alternativa D.Questão 78
ClO–(aq) + H2O(l) ↔ HClO(aq) + OH–(aq)
Em um processo de limpeza, quantidades iguais de água sanitária foram adicionadas a volumes iguais de líquidos com diferentes valores de pH a 25 ºC, de acordo com a tabela.
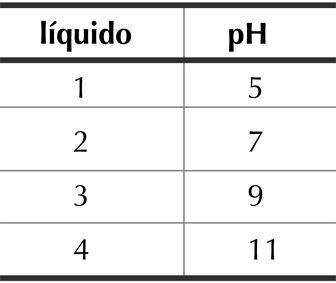 O líquido no qual a água sanitária apresenta maior ação desinfetante é o de número:
O líquido no qual a água sanitária apresenta maior ação desinfetante é o de número:- A) 1
- B) 2
- C) 3
FAZER COMENTÁRIO- D) 4
A alternativa correta é letra A
O líquido no qual a água sanitária apresenta maior ação desinfetante é o de número 1, pois quanto menor for o pH desta solução (pH < 7), maior a concentração de íons H+ presente na solução fazendo com que o equilíbrio seja deslocado para a esquerda (consumindo o ácido hipocloroso e íon hidróxido para formação do íon hipoclorito e água). Maior concentração de íons H+ (pH<7), maior a ação desinfetante da água sanitária, o qual age destruindo os micro-organismos com maior eficiência.Portanto, a resposta correta é a alternativa A.Questão 79
 A leitura da mensagem no experimento descrito é possível porque a presença de íons OH– na solução de fenolftaleína promove deslocamento do equilíbrio para aFAZER COMENTÁRIO
A leitura da mensagem no experimento descrito é possível porque a presença de íons OH– na solução de fenolftaleína promove deslocamento do equilíbrio para aFAZER COMENTÁRIO- A) direita, devido à diminuição do grau de ionização da fenolftaleína.
- B) direita, devido ao aumento da concentração de íons H+.
- C) direita, devido ao consumo de íons H+ pelos íons OH–.
- D) esquerda, devido ao consumo de íons H+ pelos íons OH–.
- E) esquerda, devido à diminuição do grau de ionização da fenolftaleína.
A alternativa correta é letra C
O deslocamento ocorre para a direita porque os íons OH- consumirão os íons H+ disponíveis. Conforme enuncia o princípio de Le Chatelier: quando um sistema químico em estado de equilíbrio é perturbado por uma mudança numa propriedade, o sistema ajusta-se de forma que se opõe à mudança. Neste caso, íons H+ estão sendo consumidos e o sistema reestabelecerá um novo equilíbrio gerando mais íons H+ e isso será possível deslocadondo-se para direita o equilíbrio e aumentando novamente sua concentração.Continua após a publicidade..Questão 80
N2(g) + 3 H2(g) ↔ 2 NH3(g)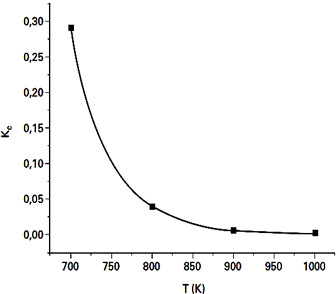 Sobre o comportamento dessa reação, no intervalo de temperatura considerado no experimento, foram feitas algumas afirmações:I. A reação é exotérmica no sentido de formação da amônia.II. Com o aumento da temperatura, a velocidade da reação diminui.III. Com o aumento da temperatura, o rendimento da reação diminui, formando-se menos amônia na situação de equilíbrio.SOMENTE está correto o que se afirma emSobre o comportamento dessa reação, no intervalo de temperatura considerado no experimento, foram feitas algumas afirmações:I. A reação é exotérmica no sentido de formação da amônia.II. Com o aumento da temperatura, a velocidade da reação diminui.III. Com o aumento da temperatura, o rendimento da reação diminui, formando-se menos amônia na situação de equilíbrio.SOMENTE está correto o que se afirma em
Sobre o comportamento dessa reação, no intervalo de temperatura considerado no experimento, foram feitas algumas afirmações:I. A reação é exotérmica no sentido de formação da amônia.II. Com o aumento da temperatura, a velocidade da reação diminui.III. Com o aumento da temperatura, o rendimento da reação diminui, formando-se menos amônia na situação de equilíbrio.SOMENTE está correto o que se afirma emSobre o comportamento dessa reação, no intervalo de temperatura considerado no experimento, foram feitas algumas afirmações:I. A reação é exotérmica no sentido de formação da amônia.II. Com o aumento da temperatura, a velocidade da reação diminui.III. Com o aumento da temperatura, o rendimento da reação diminui, formando-se menos amônia na situação de equilíbrio.SOMENTE está correto o que se afirma em- A) I.
- B) II.
- C) III.
- D) I e II.
FAZER COMENTÁRIO- E) I e III.
« Anterior 1 … 6 7 8 9 10 11 Próximo »A alternativa correta é letra E
Afirmativa I: CorretaPelo gráfico, o Kc diminui com o aumento da temperatura, assim, pode-se perceber que a reação libera calor ao invés de consumí-lo.Afirmativa II: ErradaNão ocorre uma diminuição da velocidade da reação, occorre sim uma mudança da direção dela, que, no caso de aumento de temperatura, a reação é deslocada para a esquerda.Afirmtiva III: CorretaCom o Kc menor, ocorre menor formação de produtos. Isso altera o rendimento da reação. - B) II.
- B) 2
- B) II
- B) I e II, apenas.
- B) A metilamina é um ácido de Lewis.
