Questões Sobre Estequiometria - Química - 2º ano do ensino médio
11) A solução aquosa de HBr a 20 °C, que tem densidade 1,5g/mL, apresenta concentração, em mol/L, aproximadamente igual a
- A) 5,8.
- B) 7,2.
- C) 8,9.
- D) 15.
FAZER COMENTÁRIO- E) 26.
A alternativa correta é letra C
Primeiramente, vamos determinar a massa molar do HBr:massa molar do H = 1,0 g/molmassa molar do Br = 80,0 g/molmassa molar do HBr = 1,0 + 80,0 = 81,0 g/molA partir da densidade dada da solução de HBr, podemos encontrar a massa correspondente a 1 L desta solução.1,5 g → 0,001 L (1 mL)X g → 1 LX = 1500 gPortanto, no volume de 1 L, tem-se 1500g da solução. Dado que a solução é 48% em massa de HBr, podemos determinar a massa de HBr presente em 1 L da solução:48 % de 1500 g = 720 g de HBrCom base na massa encontrada, calculamos a quantidade de matéria (em mol) de HBr correspondente:81,0 g de HBr → 1 mol720,0 g de HBr → X molX = 8,9 mol de HBrAssim, em 1 L de solução, tem-se 8,9 mol de HBr. Ou seja, a concentração da solução aquosa de HBr é de 8,9 mol/L. Alternativa correta, C.12) Uma solução aquosa de dicromato de potássio, quando resfriada a 40°C, formou 240 g de sal cristalizado. Se essa mesma solução fosse resfriada a 10°C, teria formado 340 g de sal cristalizado. Considerando-se que a cristalização é completa nas temperaturas examinadas, pode-se afirmar que a massa dessa solução de dicromato de potássio é igual a:
- A) 1 000 g.
- B) 950 g.
- C) 890 g.
- D) 800 g.
FAZER COMENTÁRIO- E) 315 g.
A alternativa correta é letra C
Analisando a curva de solubilidade para o dicromato de potássio mostrada no gráfico, podemos observar que ao resfriarmos a solução de 40ºC para 10ºC temos a cristalização de 20g de sal para cada 100g de água (diferença observada no eixo y do gráfico). Como os dados da questão nos mostram que temos a cristalização de 100g de sal quando passamos de 40ºC para 10ºC, a partir de uma simples regra de três obtemos a quantidade de água para a dada transformação, assim:Ainda do gráfico podemos ver que a 40ºC temos 30g de sal para 100g de água, o que resulta em uma massa de 130g, referente a solução. Agora, como sabemos a massa de água referente a massa de 100g de sal, podemos calcular a massa de solução, desta forma:A massa da solução original, considerando que os 340g correspondem a cristalização total, vai ser igual a massa da solução a 40ºC mais a massa de sal inicial, ou seja, 650 g + 240 g, que nos remete a alternativa C (890g) como sendo a correta.13) Uma solução aquosa de ácido cianídrico, HCN, a 25°C tem pH = 5. Sabendo-se que a constante de ionização desse ácido, a 25°C, é 5 x 10–10, então essa solução tem concentração de HCN, em g/L, igual a:
- A) 2,7.
- B) 5,4.
- C) 8,1.
- D) 10,8.
FAZER COMENTÁRIO- E) 13,5.
A alternativa correta é letra B
Inicialmente devemos considerar a equação que representa a dissociação do ácido cianídrico (HCN):HCN(aq) ↔ H+(aq) + CN-(aq)Visto que o pH da solução é 5, sabemos que a concentração de H+ é 10-5, assim podemos calcular, a partir da constante de ionização do HCN, a concentração da solução, considerando que as concentrações dos íons H+ e CN- são iguais, desta forma:Finalmente, obtemos a concentração da solução de HCN em g/L multiplicando a concentração molar da solução pela massa molar do HCN, como mostrado abaixo:Massa molar do HCN = 27 g/mol[HCN] = 0,2 mol/L . 27 g/mol = 5,4 g/ LCom isso, temos a alternativa B como sendo a alternativa correta.14) O pH do suco de um determinado limão é próximo de 2. Sendo assim, quando 100 mL desse suco são diluídos com água para o preparo de 1 L de limonada, o pH
FAZER COMENTÁRIO- A) diminui de 1 unidade.
- B) diminui de 10 unidades.
- C) aumenta de 1 unidade.
- D) aumenta de 3 unidades.
- E) aumenta de 10 unidades.
A alternativa correta é letra C
Através da equação pH=-log[H+], calcula-se a concentração de H+ presente no suco de limão, ou seja, pH ≅ 2 ∴ [H+] ≅ 10–2mol/L. Para obter o pH para a solução de 100mL desta solução para 1L (=1000mL), utiliza-se a equação C1V1=C2V2. Substituindo os valores, tem-se:
C1V1=C2V2
10–2mol/L . 100mL = C2 . 1000mL
C2 ≅ 10–3mol/LUtilizando a primeira equação, obtém-se o pH para a solução de 1L, onde pH = –log [H+] ∴ pH = –log 10–3 ,
logo pH = 3.
Portanto, o pH variou de 2 para 3, ou seja, de 1 unidade. Alternativa correta, letra C.Questão 15
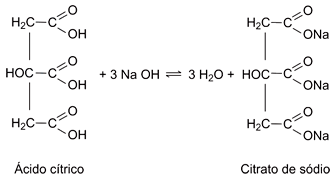 Considere que a acidez de um certo suco de laranja provenha apenas do ácido cítrico. Uma alíquota de 5,0 mL desse suco foi titulada com NaOH 0,1 mol/L, consumindo-se 6,0 mL da solução básica para completa neutralização da amostra analisada. Levando em conta estas informações e a equação química apresentada, é correto afirmar que a concentração de ácido cítrico no referido suco, em mol/L, é:
Considere que a acidez de um certo suco de laranja provenha apenas do ácido cítrico. Uma alíquota de 5,0 mL desse suco foi titulada com NaOH 0,1 mol/L, consumindo-se 6,0 mL da solução básica para completa neutralização da amostra analisada. Levando em conta estas informações e a equação química apresentada, é correto afirmar que a concentração de ácido cítrico no referido suco, em mol/L, é:- A) 2,0.10–4
- B) 6,0.10–4
- C) 1,0.10–2
- D) 1,2.10–2
FAZER COMENTÁRIO- E) 4,0.10–2
A alternativa correta é letra E
Pela equação química apresentada, tem-se que a razão molar de NaOH : Ácido Cítrico é igual a 3:1.Em 6,0mL da solução de NaOH, tem-se uma quantidade molar igual a 6,0.10-4 mol. Dessa forma, adotando a razão molar entre o ácido e a base, chega-se que a quantidade molar de ácido cítrico é igual a 2,0.10-4 mol.Assim, pode-se dizer que a concentração de ácido cítrico no suco é de:Portanto, a resposta correta é a alterntativa E.16) A azia é muitas vezes devida a uma alteração no pH do estômago, causada por excesso de ácido clorídrico. Antiácidos como o leite de magnésia neutralizam este ácido. O leite de magnésia apresenta em sua composição 64,8 g de hidróxido de magnésio, Mg(OH)2, por litro da suspensão. A quantidade de ácido que será neutralizada se uma pessoa ingerir duas colheres de sopa (volume total de 9 mL) de leite de magnésia é:
- A) 0,02 mols.
- B) 20 mols.
- C) 200 mols.
- D) 0,01 mols.
FAZER COMENTÁRIO- E) 0,58 mols.
A alternativa correta é letra A
Primeiramente, determina-se a massa molar do Mg(OH)2:MM [Mg(OH)2] = 24,3 + 2.16 + 2.1
MM [Mg(OH)2] = 58,3 g/mol
Em seguida, é determinada a massa de Mg(OH)2 contidos em 9 mL da solução de leite de magnésia:1 L --------- 64,8 g Mg(OH)20,009 L --------- xx = 64,8 . 0,009x = 0,5832 gPassando isso para quantidade de matéria, tem-se:n = 0,5832 / 58,3n = 0,01 mol de Mg(OH)2A reação de neutralização que ocorre é a seguinte:2 HCl (aq) + Mg(OH)2 (aq) ↔ MgCl2 (aq) + 2 H2ODesse modo, a quantidade de HCl neutralizada será o dobro da quantidade utilizada de Mg(OH)2. Assim, serão neutralizados 0,02 mol de HCl.
Portanto, a resposta correta é a alternativa A.17) A nitroglicerina é um poderoso explosivo obtido pela nitração da glicerina, conforme a reação que segue. C3H5(OH) 3+ 3 HNO3→ C3H5(ONO2) 3+ 3 H2O Se utilizarmos uma amostra de 100 g glicerina com 90% de pureza, a massa de nitroglicerina obtida é, aproximadamente: (Dadas as massas atômicas em g/mol: H = 1, C = 12, N = 14, O = 16)
- A) 340 g.
- B) 225 g.
- C) 185 g.
- D) 130 g.
FAZER COMENTÁRIO- E) 87 g.
A alternativa correta é letra B
Inicialmente, devemos calcular as massas moleculares da glicerina e da nitroglicerina, desta forma:Glicerina [C3H5(OH)3] -Nitroglicerina [C3H5(NO3)3]-Em seguida, calculamos a quantidade, em g, de nitroglicerina obtida. Para este propósito, consideraremos que a relação entre o reagente (glicerina) e o produto (nitroglicerina) é de 1:1 e que apenas 90% do reagente é glicerina, ou seja, 90 g, assim:Desta forma, a alternativa correta é a alternativa b.18) Aplicando a Lei de Gay-Lussac, das combinações em volume, qual a contração em volume experimentada na reação abaixo, mantendo-se constantes as condições de pressão e temperatura para os reagentes e produtos, todos gasosos ?
- A) 100%
- B) 80%
- C) 60%
- D) 50%
FAZER COMENTÁRIO- E) 40%
A alternativa correta é letra D
Sabe-se que a Lei de Gay-Lussac é aplicada a gases ideiais e afirma que a proporção volumétrica dos gases em uma reação (volumes medidos à mesma pressão e temperatura) é constante.De acordo com essa lei, a diferença entra a soma dos volumes dos gases reagentes (S) e o volume do produto (V) é a contração, dada pela seguinte relação:A fração do volume inicial que diminui é denominada de contração seletiva e é o que se requer no enunciado da questão:Seguindo a relação estequiométrica, tem-se:N2: H2: NH31: 3: 2Volume total de Reagentes: 4vVolume total de Produtos: 2vCalculando-se a contração seletiva:Assim, nota-se que ao admitirmos que todo reagente é consumido, há uma redução de 50% do seu volume.Portanto, a resposta correta é a alternativa D.19) Amônia gasosa pode ser preparada pela seguinte reação balanceada: CaO(s) + 2NH4Cl(s) → 2NH3(g) + H2O(g) + CaCl2(s) Se 112,0 g de óxido de cálcio e 224,0 g de cloreto de amônia forem misturados, então a quantidade máxima, em gramas, de amônia produzida será, aproximadamente Dados: Massas molares CaO=56g/mol; NH4Cl=53,5g/mol; NH3=17g/mol
- A) 68,0
- B) 34,0
- C) 71,0
- D) 36,0
FAZER COMENTÁRIO- E) 32,0
A alternativa correta é letra A
Segundo a equação, 1 mol de CaO reage com 2 mols de NH4Cl gerando 2 mols de NH3.Dessa forma, 56 g de CaO reagem com 107 g (2x53,5) de NH4Cl gerando 34 g (2x17) de NH3.Como 112 é o dobro de 56, ao dobrarmos as quantidades acima iremos obter a quantidade de reagentes e produtos.Se colocarmos 112 g de CaO reage com 214 g de NH4Cl gerando 68 g de NH3.Continua após a publicidade..20) Trilhos de ferrovias podem ser soldados com o uso da reação conhecida como termite. Essa reação consiste em aquecer alumínio em pó misturado a óxido de ferro (III), Fe2O3. Como produtos da reação, formam-se ferro metálico (que solda os trilhos) e óxido de alumínio, Al2O3. Na equação química que representa essa reação, quando o coeficiente estequiométrico do alumínio for 1 , o coeficiente estequiométrico do óxido de ferro (III) será
- A) 1/3 .
- B) 1/2.
- C) 1.
- D) 2 .
FAZER COMENTÁRIO- E) 3.
« Anterior 1 2 3 4 5 Próximo »A alternativa correta é letra B
Montando a equação da reação e considerando o coeficiente estequiométrico do alumínio igual a 1, tem-se:1 Al + Fe2O3 → Fe + Al2O3balanceando a equação dada, obtém-se:1 Al + 1/2Fe2O3 → 1Fe + 1/2Al2O3Então, o coeficiente estequiométrico do óxido de alumínio (III) igual a 1/2. Alternativa B. - B) 1/2.
- B) 34,0
- B) 80%
- B) 225 g.
- B) 20 mols.
- B) 6,0.10–4
- B) 5,4.
- B) 950 g.
- B) 7,2.
