Questões Sobre Estequiometria - Química - 2º ano do ensino médio
31) Uma forma de se obter oxigênio em laboratório é pela reação química entre solução aquosa de peróxido de hidrogênio (água oxigenad
- A) e solução aquosa de permanganato de potássio em meio ácido, cuja equação, parcialmente balanceada, é:x KMnO4(aq) + 3H2SO4(aq) + yH2O2(aq) → → K2SO4(aq) + 2MnSO4(aq) + zO2(g) + 8H2O(l)Nessa equação, os valores dos coeficientes estequiométricos x, y e z são, respectivamente,FAZER COMENTÁRIO
A alternativa correta é letra B
A estequiometria permite relacionar a quantidade de reagentes e produtos com o auxílio das equações químicas correspondentes.
A reação exposta trata-se de uma reação de oxirredução, onde então ocorre a transferência de elétrons e uma substância é oxidada (perde elétrons) e a outra reduzida (ganha elétrons).
O manganês inicialmente como reagente no permanganato possuía carga 7+ e após reação passou a sulfato de manganês com carga 2+. Logo, tem-se que houve o ganho de 5 elétrons e por isso ele se reduziu. Esses elétrons recebidos são provenientes do oxigênio, que no peróxido possuía carga 1-, mas por ter dois oxigênios nas moléculas, tem-se então 2-. Como ele se transformou em oxigênio molecular sua carga é 0. Sendo assim:
Como deve haver a transferência dos mesmos números de elétrons para ocorrer a oxirredução, precisa-se ajustar estequiometricamente. Multiplicando-se um pelo outro, tem-se:
redução (KMnO4) e– = 5 . 1 = 5 (x 2) = 10 elétrons (x = 2)
oxidação (H2O2) e– = 1 . 2 = 2 (x 5) = 10 elétrons (y = 5)
Com isso, tem-se que dois mols permanganato devem reagir com 5 mols de peróxido para efetuar a reação desejada. Com isso, obtemos os valores de x=2 e y=5.
Para descobrir o valor de z, igualamos a quantidade de oxigênio dos outros membros e vemos quanto falta no segundo membro e completamos com o coeficiente.
1.o membro (átomos de O) = 2.o membro (átomos de O)
8 + 12 + 10 = 4 + 8 + 2z + 8
z = 5
Temos então a alternativa correta letra B: x = 2, y = 5, z = 532) O “cheiro forte” da urina humana deve-se principalmente à amônia, formada pela reação química que ocorre entre ureia, CO(NH2)2, e água:
- A) 0,5
- B) 1,0
- C) 1,5
- D) 2,0
FAZER COMENTÁRIO- E) 5,0
A alternativa correta é letra E
A reação química que leva à formação, principalmente, de amônia é a descrita no enunciado. Para saber o volume de amônia, medido nas CATP, formado quando 6,0 g de ureia reagem completamente com água, faz-se necessário relacionar o número de mols da ureia com a amônia. Analisando a equação, nota-se que a proporção é de 1 mol de ureia para 2 mols de amônia. Então, relacionando os dados acima com os dados nas CATP e a massa molar da ureia (MMureia = 60 g/mol) pode realizar o seguinte cálculo:60 g de ureia → 2 mols de NH3 × 25 L/mol
6,0 g de ureia → x L de NH3Assim, encontramos que serão produzidos 5,0 L de NH3. Portanto, a resposta correta é a alternativa E.33) O hidrocarboneto n-octano é um exemplo de substância presente na gasolina. A reação de combustão completa do n-octano pode ser representada pela seguinte equação não balanceada:
- A) gás carbônico produzido, em massa, é maior que a de gasolina queimada.
- B) produtos, em mol, é menor que a quantidade de reagentes.
- C) produtos, em massa, é maior que a quantidade de reagentes.
FAZER COMENTÁRIO- D) água produzida, em massa, é maior que a de gás carbônico.
A alternativa correta é letra A
Inicia-se o balanceamento da reação com a igualdade no número de carbonos, em seguida parte-se para os átomos de hidrogênio restantes e por último o balanceamento do oxigênio.
Seguindo este procedimento, tem-se o seguinte:C8H18(g) + 25/2 O2(g) → 8CO2(g) + 9H2O(g)
Observa-se que a quantidade mássica de CO2 (8 x 44g= 352g) é maior que a massa inicial de gasolina ( 114g).
Portanto, a resposta correta é a alternativa A.34) Qual o número de mols de etano (C2H6) contidos em 3,01.1023 moléculas dessa substância.
- A) 2 mols.
- B) 1 mol.
- C) 0,5 mols.
- D) 2,5 mols.
FAZER COMENTÁRIO- E) 5 mols.
A alternativa correta é letra C
Considerando a constante de Avogadro como sendo 6,02.1023moléculas/mol, tem-se:Assim, se 6,02 x 1023 moléculas correspondem a 1 mol de moléculas, a metade deste valor (3,01 x 1023) corresponde a 0,5 mol de qualquer substância.Portanto, a resposta correta é a alternativa C.35) O número de mols correspondentes a 4,0g de NaOH é:
- A) 0,1
- B) 0,4
- C) 1
- D) 4
FAZER COMENTÁRIO- E) 40
A alternativa correta é letra A
Com as massas de cada elemento, pode-se calcular a massa molar do NaOH, sendo igual a 40g/mol.Assim, a quantidade, em mols, equivalente a 4,0g de NaOH é igual a:n = 4,0/40,0n = 0,1 molPortanto, a resposta correta é a alternativa A.36) O etanol pode ser utilizado como combustível em motores de combustão interna. A combustão completa do etanol pode ser representada pela seguinte equação química balanceada:
- A) C2H5OH + 3 O2 → 2 CO2 + 3 H2O
- B) C2H5OH + 2 O2 → 2 CO + 3 H2O
- C) C2H5OH + O2 → 2 C + 3 H2O
FAZER COMENTÁRIO- D) C2H5OH + 3,5 O2 → 2 CO2 + 3 H2O
A alternativa correta é letra A
O etanol é classificado na Química Orgânica como um álcool. A reação de combustão completa dos álcoois envolve a reação com o oxigênio e a formação de gás carbônico e água.
Com base nesta informação, pode-se descartas as alternativas b e c, em que há formação de produtos que não condizem com a combustão do etanol.
Entre as alternativas a e d, o fator de escolha é a estequiometria da reação. Sabendo-se que não há variação nas quantidades de átomos envolvidos antes e depois de ocorrer uma reação química, podemos avaliar qual das duas equações está correta.
Na alternativa a, temos:
Reagentes: 2 átomos de C; 6 átomos de H; 7 átomos de O
Produtos: 2 átomos de C; 6 átomos de H; 7 átomos de O
Na alternativa d:
Reagentes: 2 átomos de C; 6 átomos de H; 8 átomos de O
Produtos: 2 átomos de C; 6 átomos de H; 7 átomos de O
Desta forma, concluímos que a alternativa correta é A.37) Para cada mol de xenônio que reage completamente, a massa do produto formado na reação é, em gramas,
- A) 131.
- B) 195.
- C) 220.
- D) 326.
FAZER COMENTÁRIO- E) 440.
A alternativa correta é letra E
Inicialmente, devemos observar que a relação entre o xenônio e o produto formado é de 1:1. Com isso, após calcularmos a massa molar do produto, podemos obter a massa do complexo formado na reação, desta forma:Como a relação entre o reagente e o produto é de 1:1, temos que 1mol de Xe forma 1mol de Xe+PtF6-, que tem massa molar igual a 440g, o que nos remete a alternativa E como sendo a correta.38) A combinação entre o nitrogênio e o oxigênio pode originar diferentes óxidos. Entre os óxidos nitrogenados a seguir, aquele que apresenta, em sua composição, o maior teor ponderal de nitrogênio é o:
- A) NO;
- B) NO2;
- C) N2O;
- D) N2O3;
FAZER COMENTÁRIO- E) N2O5;
A alternativa correta é letra C
Sabendo que o teor ponderal de nitrogênio é definido pela massa molar total de nitrogênio dividida pela massa molar do óxido, tem-se os seguintes teores nos óxidos citados:NO: 46,67 %NO2: 30,43 %N2O: 63,63 %N2O3: 36,84 %N2O5: 25,92 %Assim, o óxido com maior teor de nitrogênio é o N2O.Portanto, a resposta correta é a alternativa C.39) Dos compostos a seguir, qual apresenta massa molecular igual a 30?
- A) C2H6
- B) PH3
- C) NH3
- D) NO2
FAZER COMENTÁRIO- E) N2O3
A alternativa correta é letra A
Sabendo que a massa atômica do carbono é de 12u.m.a., do hidrogênio é 1u.m.a., do oxigênio é 16, do nitrogênio é 14 e do fósforo é de 31, tem-se que a massa de cada molécula é a seguinte:C2H6: 30u.m.a.PH3: 34u.m.a.NH3: 17u.m.a.NO2: 46u.m.a.N2O3: 76u.m.a.Portanto, a resposta correta é a alternativa A.Continua após a publicidade..Questão 40
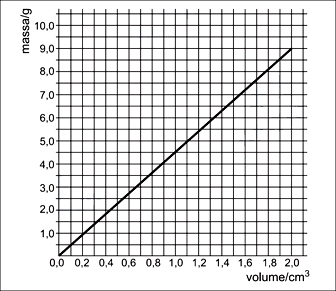 Analisando-se esse gráfico, conclui-se que a densidade do metal em questão é, em g/cm3, igual a aproximadamente
Analisando-se esse gráfico, conclui-se que a densidade do metal em questão é, em g/cm3, igual a aproximadamente- A) 1,5.
- B) 2,5.
- C) 3,0.
- D) 4,5.
FAZER COMENTÁRIO- E) 6,0.
« Anterior 1 2 3 4 5 Próximo »A alternativa correta é letra D
Analisando-se este gráfico e sabendo que , pega-se dois pontos quaisquer no gráfico, neste iremos pegar os pontos m=5 g e m=0g e seus respectivos volumes e colocando na equação acima, tem-se:Conclui-se que a densidade do metal em questão é, aproximadamente 4,5 g/cm3. Alternativa D. - B) 2,5.
- B) PH3
- B) NO2;
- B) 195.
- B) C2H5OH + 2 O2 → 2 CO + 3 H2O
- B) 0,4
- B) 1 mol.
- B) produtos, em mol, é menor que a quantidade de reagentes.
- A) 0,5
