Questões Sobre Reações Químicas - Ciências - 9º ano
1) Todos os fenômenos descritos são exemplos de reações químicas, exceto:
- A) dissolução de um comprimido efervescente.
- B) eletrólise da água.
- C) enferrujamento de um prego exposto ao ar.
- D) fusão de parafina.
- E) queima de uma vela.
A alternativa correta é letra E) queima de uma vela.
Em uma reação química, os átomos das substâncias iniciais se rearranjam para formar novas substâncias com propriedades diferentes. Isso significa que há uma mudança na composição química.
Vamos analisar as opções:
A) A dissolução de um comprimido efervescente envolve uma reação química, pois quando o comprimido se dissolve na água, ocorre uma reação que libera gás carbônico.
B) A eletrólise da água é uma reação química onde a água é decomposta em hidrogênio e oxigênio através da passagem de uma corrente elétrica.
C) O enferrujamento de um prego exposto ao ar é uma reação química conhecida como oxidação, onde o ferro reage com o oxigênio formando óxido de ferro, ou seja, a ferrugem.
E) A queima de uma vela envolve reações químicas de combustão, onde a parafina da vela reage com o oxigênio do ar produzindo dióxido de carbono e água.
D) A fusão de parafina, no entanto, é um fenômeno físico e não uma reação química. Isso porque a parafina apenas muda de estado, de sólido para líquido, sem alterar sua composição química. É um processo físico de mudança de estado, semelhante ao derretimento do gelo, que continua sendo água.
Portanto, a resposta correta é a opção D, a fusão de parafina.
2) Complete o texto com os termos que faltam para que este tenha sentido e assinale a alternativa correta:
I. Uma reação química ocorre quando um material passa por uma _____________ em que sua constituição muda, ou seja, seus átomos se rearranjam para formar novas ____________.
II. Nas reações químicas, as substâncias iniciais são chamadas de __________ e as finais de __________, e as reações são representadas por meio de equações químicas.
A) reação, moléculas, produtos, reagentes.
B) modificação, estruturas, substâncias, moléculas.
C) movimentação, misturas, átomos, modificadas.
D) transformação, substâncias, reagentes, produtos
A alternativa correta para completar o texto é a letra D.
Veja como ficaria o texto com os termos que faltam:
I. Uma reação química ocorre quando um material passa por uma transformação em que sua constituição muda, ou seja, seus átomos se rearranjam para formar novas substâncias.
II. Nas reações químicas, as substâncias iniciais são chamadas de reagentes e as finais de produtos, e as reações são representadas por meio de equações químicas.
3) Uma reação química consiste em três reagentes, K, L e M, e dois produtos, N e O com a proporção em massa de 30:25:40:45:50. Se a massa que reagiu de K era de 90, qual é a massa de todos os outros componentes da reação?
FAZER COMENTÁRIOResposta correta:
K: 90
L: 75
M: 120
N: 135
O: 150
Uma maneira de resolver este problema é usar a regra da proporção. A regra da proporção diz que a razão entre as massas dos reagentes e dos produtos é igual à razão entre as proporções em massa dos mesmos. Assim, podemos escrever a seguinte equação:
90/30 = L/25 = M/40 = N/45 = O/50
Agora, podemos resolver para as massas desconhecidas de L, M, N e O, multiplicando ambos os lados da equação pela proporção em massa correspondente. Por exemplo, para encontrar a massa de L, podemos fazer:
L = 90/30 × 25
L = 75
Da mesma forma, podemos encontrar as massas de M, N e O, fazendo:
M = 90/30 × 40
M = 120
N = 90/30 × 45
N = 135
O = 90/30 × 50
O = 150
Portanto, as massas de todos os componentes da reação são:
K: 90
L: 75
M: 120
N: 135
O: 150
4) Uma reação química consiste em dois reagentes, X e Y, e um produto, Z. A massa de X foi determinada antes da reação acontecer e era 58g. A massa de Z foi determinada após a reação ocorrer e é 112g. Qual a massa de Y?
FAZER COMENTÁRIOA resposta é massa de Y igual a 54 g.
De acordo com a lei de conservação da massa, a massa total dos reagentes é igual à massa total dos produtos em uma reação química1. Isso significa que a soma das massas de X e Y deve ser igual à massa de Z. Assim, podemos usar uma equação simples para encontrar a massa de Y:
massa de X + massa de Y = massa de Z
Substituindo os valores dados, temos:
58 g + massa de Y = 112 g
Isolando a massa de Y, obtemos:
massa de Y = 112 g – 58 g
massa de Y = 54 g
Portanto, a massa de Y é 54 g.
5) Uma transformação ou fenômeno químico ocorre quando a natureza ou composição da matéria é alterada, por meio de uma reação química. Quais as partes de uma reação química e qual o símbolo que representa a transformação química?
FAZER COMENTÁRIOAs partes de uma reação química são os reagentes e os produtos. Os reagentes são as substâncias que estão no início da reação, que sofrem a transformação química. Os produtos são as substâncias que resultam da reação, que têm composição diferente dos reagentes.
O símbolo que representa a transformação química é uma seta que aponta para o lado direito, indicando o sentido da reação. Por exemplo, a reação de combustão do metano (CH4) com o oxigênio (O2) pode ser representada pela seguinte equação química:
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H 2 O(v)
6) Analise as afirmativas a seguir relacionadas às Leis Ponderais.
I – A Lei de Proust indica que uma determinada substância composta é formada por substâncias mais
simples, unidas com diferentes proporções em massa.
II – A Lei de Lavoisier estabelece que determinadas substâncias sempre reagem com outras a partir de uma
proporção definida das massas envolvidas.
III – Em uma equação química, as substâncias indicadas antes da seta representam as substâncias
responsáveis por promover a reação e, por isso, são chamadas de reagentes.
IV – Para Lavoisier, se uma reação química for realizada em um sistema fechado, a soma das massas dos
reagentes será sempre igual à soma das massas dos produtos.
Assinale a alternativa que indica as afirmações corretas acerca do tema:
- A) II e III.
- B) III e IV.
- C) I, II e III.
- D) II, III e IV.
Alternativa correta letra B) III e IV.
A afirmativa I está errada, pois a Lei de Proust indica que uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa123.
A afirmativa II está errada, pois a Lei de Lavoisier estabelece que a soma das massas das substâncias reagentes em um recipiente fechado é igual à soma das massas dos produtos da reação12.
A afirmativa III está certa, pois em uma equação química, as substâncias indicadas antes da seta representam as substâncias responsáveis por promover a reação e, por isso, são chamadas de reagentes2.
A afirmativa IV está certa, pois para Lavoisier, se uma reação química for realizada em um sistema fechado, a soma das massas dos reagentes será sempre igual à soma das massas dos produtos
7) Em um experimento, foram misturados 6g de carbono e 16g de oxigênio, resultando na formação de Gás Carbônico (CO2). Se misturarmos 12g de carbono com 32g de oxigênio para formar o Gás Carbônico, qual lei ponderal está sendo aplicada:
- A) Lei de Lavoisier.
- B) Lei das Proporções Múltiplas.
- C) Lei das Proporções Constantes.
- D) Lei da Conservação das Massas.
A resposta correta é a letra C) Lei das Proporções Constantes.
Essa lei, também chamada de Lei de Proust, afirma que uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa1. No caso do experimento, a proporção entre as massas de carbono e oxigênio que reagem para formar o gás carbônico é de 1:2, tanto para 6g de carbono e 16g de oxigênio, quanto para 12g de carbono e 32g de oxigênio. Essa proporção é constante e definida para essa substância composta.
8) Proust verificou que as massas dos reagentes e as massas dos produtos que participam da reação obedecem sempre a uma proporção constante. Essa proporção é característica de cada reação, isto é, independe da quantidade de reagentes utilizados. Exemplo queima do carvão:
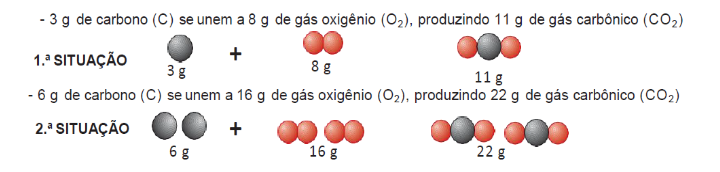
Observe a figura da 1ᵃ situação acima, do exemplo da queima do carvão, e identifique
- A) Reagentes:_______________
- B) Produtos: _______________
- C) Nº. de átomos dos reagentes _____ Nº. de átomos dos produtos _____
- D) Equação química:_______________________
- E) Podemos dizer que a Lei da Conservação de Massa foi observada? Justifique a sua resposta.
A) Reagentes: carbono C e oxigênio (O2)
B) Produtos: gás carbônico (CO2)
C) Nº. de átomos dos reagentes: 9 átomos de carbono e 24 átomos de oxigênio
Nº. de átomos dos produtos: 9 átomos de carbono e 24 átomos de oxigênio
D) Equação química: C + O2 -> CO2
E) Podemos dizer que a lei da conservação de massa foi observada, pois a soma das massas dos reagentes é igual à soma das massas dos produtos em ambas as situações. Isso significa que não houve perda ou ganho de matéria na reação, apenas uma transformação.
