Continua após a publicidade..
A produção de alimentos para a população mundial necessita de quantidades de fertilizantes em grande escala, sendo que muito deles se podem obter a partir do amoníaco. Fritz Haber (1868-1934), na procura de soluções para a otimização do processo, descobre o efeito do ferro como catalisador, baixando a energia de ativação da reação. Carl Bosch (1874-1940), engenheiro químico, colega de Haber, trabalhando nos limites da tecnologia no início do século XX, desenha o processo industrial catalítico de altas pressões e altas temperaturas, ainda hoje utilizado como único meio de produção de amoníaco e conhecido por processo de Haber-Bosch. Controlar as condições que afetam os diferentes equilíbrios que constituem o processo de formação destes e de outros produtos, otimizando a sua rentabilidade, é um dos objetivos da Ciência/Química e da Tecnologia para o desenvolvimento da sociedade.
nautilus.fis.uc.pt/spf/DTE/pdfs/fisica_quimica_a_11_homol.pdf, acesso em 28.09.2012
Considere a reação de formação da amônia N2(g)+3H2(g)⇔2NH3(g) e o gráfico, que mostra a influência conjunta da pressão e da temperatura no seu rendimento.
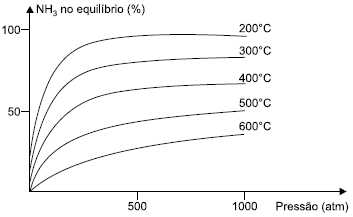
FELTRE, Ricardo. Química – vol. 2. São Paulo, Editora Moderna, 2004
A análise do gráfico permite concluir, corretamente, que:
- A) a reação de formação da amônia é endotérmica.
- B) o rendimento da reação, a 300 atm, é maior a 600 °C.
- C) a constante de equilíbrio (KC) não depende da temperatura.
- D) a constante de equilíbrio (KC) é maior a 400 °C do que a 500 °C.
- E) a reação de formação da amônia é favorecida pela diminuição da pressão.
Resposta:
A alternativa correta é letra D
Pelo gráfico, observa-se que a diminuição da temperatura aumenta o rendimento da reação, portanto, a reação direta é exotérmica e a constante de equilíbrio (KC) é maior à 400 °C do que a 500 °C. A reação de formação da amônia é favorecida pelo aumento da pressão, pois desloca o equilíbrio químico no sentido de contração de volume.
E também, o rendimento da reação a 300 atm é maior à 200 °C. Portanto, a resposta correta é a alternativa D.

Deixe um comentário