Continua após a publicidade..
O monóxido de nitrogênio é um dos poluentes atmosféricos lançados no ar pelos veículos com motores mal regulados. No cilindro de um motor de explosão interna de alta compressão, a temperatura durante a combustão do combustível com excesso de ar é da ordem de 2400 K e os gases de descarga estão ao redor de 1200 K. O gráfico representa a variação da constante de equilíbrio (escala logarítmic
- A) em função da temperatura, para a reação de formação do NO, dada porII. O aumento da pressão favorece a formação do NO.
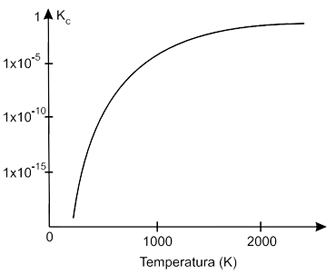 Considere as seguintes afirmações:I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em N2 e O2III. A 2400 K há maior quantidade de NO do que a 1200 K.IV. A reação de formação do NO é endotérmica.São corretas as afirmações contidas somente em
Considere as seguintes afirmações:I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em N2 e O2III. A 2400 K há maior quantidade de NO do que a 1200 K.IV. A reação de formação do NO é endotérmica.São corretas as afirmações contidas somente em
Resposta:
A alternativa correta é letra E
I) Errada - A adição de catalisadores influencia apenas na velocidade da reação e nao no deslocamento do equílibrio, logo é falsa.
II) Errada - A reação que ocorre é N2 + O2 <--> 2NO
como o aumento da pressão desloca a reação para o lado onde há menor número de mol de gás, o equilíbrio não será deslocado por aumento de pressão pois o número de mols de gás é igual nos produtos e reagentes.
III) Correta - À 2400K a constante de equílibrio é maior do que à 1200K, o que significa que a reação direta é mais favorecida, ou seja, a reação de formação de NO, portanto é verdadeira.
IV) Correta - Como a constante de equílibrio é maior com o aumento da temperatura, nota-se que a reação de formação de NO é favorecida proporcionalmente à quantidade de calor fornecida, logo é Endotérmica.

Deixe um comentário