Continua após a publicidade..
Considere um sistema fechado que contém inicialmente apenas os reagentes A e B. Essas substâncias podem reagir entre si formando dois produtos diferentes:
reação 1: A + B ⇔ X K1= 10
reação 2: A + B ⇔ Y K2= 1,0.103
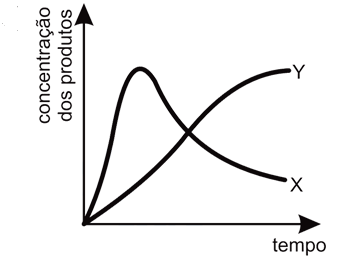
A rapidez da reação 1 é muito maior que a rapidez da reação 2. Entretanto, observa-se que a constante de equilíbrio para a reação 2 é muito maior que a reação 1. Assim, se observarmos a variação nas quantidades de X e Y dentro do recipiente e esperarmos tempo suficiente para que o sistema atinja o equilíbrio, essa variação poderá ser representada por um gráfico como:
- A)
- B)
- C)
- D)
- E)
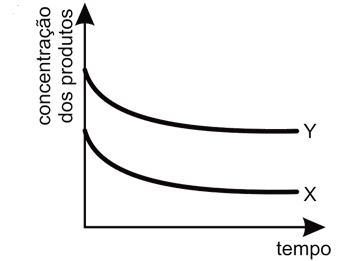
Resposta:
A alternativa correta é letra A
Ápos o sistema atingir o equilíbrio, essa variação poderá ser representada pelo gráfica como o da letra A, pois segundo as informações contidas no enunciado da questão, diz que a rapidez da reação 1 é muito maior que a rapidez da reação 2. Logo, no início da reação, há maior concentração do produto X. Entretanto, pelos valores de constante de equílibrio, nota-se que a substância Y é mais estável e portanto, com o passar do tempo, esta substância terá maior concentração que a substância X, pois esta última será consumida para formar os reagentes de partida (A e B) para a produção de Y.
Portanto, a resposta correta é a alternativa A.

Deixe um comentário