Continua após a publicidade..
A ionização do ácido cianídrico é representada pela equação química abaixo:
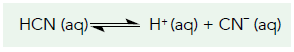
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:

Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
- A)
- B) Ka
- C) pH
- D) [HCN]
Resposta:
A alternativa correta é letra A
A questão leva em conta o conhecimento do princípio de Le Chatelier, onde este diz que quando um composto é adicionado ao sistema o equilíbrio será descolado afim de consumir o novo composto, assim observando a reação:
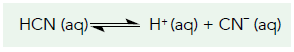
Quanto mais NaCN, mais íons CN- estarão na solução, assim o equilíbrio se deslocará no sentido contrário para o sistema entrar em equilíbrio novamente, formando mais HCN e por fim deixando o sistema com pH mais ácido e numericamente maior (lembrando que pH = – log [H+]).
Já a constante de equilíbrio não sofre alteração pois só depende da variação da temperatura.
Por fim, o grau de ionização () tem relação inversamente proporcional a quantidade de moléculas de HCN no meio. Como o equilíbrio foi deslocado por razão da adição de NaCN a concentração de HCN aumentou, portanto diminuiu.
Letra A.
Já a constante de equilíbrio não sofre alteração pois só depende da variação da temperatura.
Por fim, o grau de ionização () tem relação inversamente proporcional a quantidade de moléculas de HCN no meio. Como o equilíbrio foi deslocado por razão da adição de NaCN a concentração de HCN aumentou, portanto diminuiu.
Letra A.

Deixe um comentário