Continua após a publicidade..
A constante de equilíbrio da reação de dimerização de C5H6, representada pela equação
2C5H6 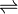 C10H12 é igual a 3,0 mol–1 · L, a 250°C.
C10H12 é igual a 3,0 mol–1 · L, a 250°C.
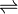 C10H12 é igual a 3,0 mol–1 · L, a 250°C.
C10H12 é igual a 3,0 mol–1 · L, a 250°C.Nessa temperatura, foram feitas duas misturas do monômero com o dímero, com as seguintes concentrações iniciais, expressas em mol/L:
Mistura 1: [monômero] = 0,50 e [dímero] = 0,75
Mistura 2: [monômero] = 1,00 e [dímero] = 2,50
Representando-se:
– situação de equilíbrio por 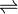 ,
,
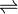 ,
,– tendência do equilíbrio se deslocar para a formação
do dímero por →,
– tendência do equilíbrio se deslocar para a formação do monômero por ←, assinale a alternativa que representa a situação correta das misturas 1 e 2 no instante em que elas foram preparadas.

- A)
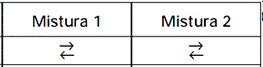
- B)

- C)

- D)

- E)

Resposta:
A alternativa correta é letra B
A questão aborda o conceito de equílibrio químico, mais precisamente busca que se faça a análise se determinada mistura encontra-se em equilíbrio ou não. Para resolvê-la, calcularemos o quociente (Q) [C10H12]/[C5H6]2 e analisar se este é maior, menor ou igual à constante de equílibrio para prever o sentido em que a reação será deslocada ou se ela encontra-se em equílibrio.
Mistura 1: Q = (0,75)/(0,5)2 = 3, 0
Logo a mistura 1 encontra-se em equílibrio pois Q = Kc = 3,0 mol–1
Mistura 2 : Q = (2,50)/(1,00)2 = 2,5 mol–1
Logo Q< Kc, para o equílibrio ser atingido o valor de Q deve aumentar, como Q = [C10H12]/[C5H6]2, para ocorrer aumento, deve-se aumentar [C10H12] ou diminuir [C5H6], portanto, para isso, o equílibrio deve ser deslocado para a direita (→).
Com isso, a resposta correta é B

Deixe um comentário