Continua após a publicidade..
A uma determinada temperatura, as substâncias HI, H2 e I2 estão no estado gasoso. A essa temperatura, o equilíbrio entre as três substâncias foi estudado, em recipientes fechados, partindo-se de uma mistura equimolar de H2 e I2 (experimento “A”) ou somente de HI (experimento “B”).
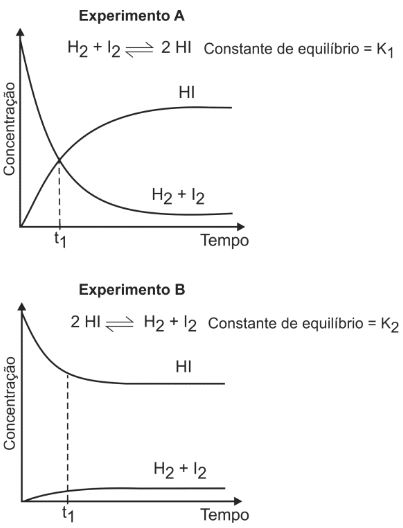
Pela análise dos dois gráficos, pode-se concluir que:
- A) no experimento A, ocorre diminuição da pressão total no interior do recipiente, até que o equilíbrio seja atingido.
- B) no experimento B, as concentrações das substâncias (HI, H2 e I2) são iguais no instante t1.
- C) no experimento A, a velocidade de formação de HI aumenta com o tempo.
- D) no experimento B, a quantidade de matéria (em mols) de HI aumenta até que o equilíbrio seja atingido.
- E) no experimento A, o valor da constante de equilíbrio (K1) é maior do que 1.
Resposta:
A alternativa correta é letra E
A pressão do sistema só sofre variação se houver diminuição ou aumento do número total de mols de componentes gasosos dos produtos em relação aos reagentes. No experimento A, a pressão total do experimento permanece a mesma, uma vez que a quantidade total de mols dos reagentes é igual à quantidade de mols do produto. As concentrações das três substâncias são iguais no instante t1 apenas no experimento A. No experimento B, a concentração de HI é maior que as concentrações de H2 e I2, que são iguais. Percebe-se que, com o passar do tempo, a quantidade de HI formado diminui, ou seja, se forma menos HI com o aumento do tempo. Como a velocidade de formação de uma substância é diretamente proporcional à sua concentração, a velocidade de formação de HI diminui com o aumento do tempo. No experimento B, a curva decrescente no gráfico indica que a quantidade de matéria de HI diminui com o tempo até atingir o equilíbrio. O valor da constante de equilíbrio é dado pela equação abaixo:
E como:
Logo:
Portanto, a resposta correta é a alternativa E.

Deixe um comentário