Continua após a publicidade..
A molécula do hexafluoreto de enxofre (SF6) tem a forma geométrica de um octaedro regular. Os centros dos átomos de flúor correspondem aos vértices do octaedro, e o centro do átomo de enxofre corresponde ao centro desse sólido, como ilustra a figura abaixo.
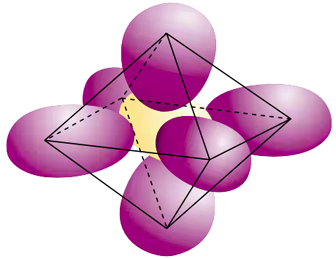
(www.escuelaintegral.edu.uy)
Considere que a distância entre o centro de um átomo de flúor e o centro do átomo de enxofre seja igual a 1,53 oA.
Assim, a medida da aresta desse octaedro, em oA, é aproximadamente igual a:
Assim, a medida da aresta desse octaedro, em oA, é aproximadamente igual a:
- A) 1,53
- B) 1,79
- C) 2,16
- D) 2,62
Resposta:
A alternativa correta é letra C
Apesar de envolver a geometria molecular do composto citado, esta questão pode ser resolvida apenas com conhecimentos de geometria espacial.
Sendo a molécula um octaedro regular, é formado por uma base quadrada e por triângulos equiláteros que se unem formando o poliedro representado na figura.
Sabendo-se que os centros dos átomos de flúor estão localizados nos vértices do octaedro e que o centro do enxofre corresponde ao centro (centro da base quadrada) desta figura, podemos calcular o que se pede.
A distância entre o centro de um átomo de flúor e o centro do átomo de enxofre corresponde à metade da diagonal do quadrado. Ou seja, a diagonal do quadrado que forma a base da figura é 2 x 1,53 oA, igual a 3,06°A.
Considerando-se a figura ilustrativa abaixo, temos a base quadrada do octaedro e um dos triângulos (todos são iguais, num total de oito triângulos) que formam os lados do octaedro.
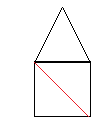
Para o quadrado, todos os lados são iguais e considerando o triângulo retângulo formado por dois lados consecutivos (l) deste quadrado e sua diagonal (d), temos:
Sendo a molécula um octaedro regular, é formado por uma base quadrada e por triângulos equiláteros que se unem formando o poliedro representado na figura.
Sabendo-se que os centros dos átomos de flúor estão localizados nos vértices do octaedro e que o centro do enxofre corresponde ao centro (centro da base quadrada) desta figura, podemos calcular o que se pede.
A distância entre o centro de um átomo de flúor e o centro do átomo de enxofre corresponde à metade da diagonal do quadrado. Ou seja, a diagonal do quadrado que forma a base da figura é 2 x 1,53 oA, igual a 3,06°A.
Considerando-se a figura ilustrativa abaixo, temos a base quadrada do octaedro e um dos triângulos (todos são iguais, num total de oito triângulos) que formam os lados do octaedro.

Para o quadrado, todos os lados são iguais e considerando o triângulo retângulo formado por dois lados consecutivos (l) deste quadrado e sua diagonal (d), temos:
Teorema de Pitágoras
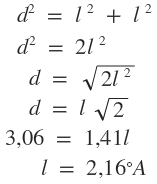
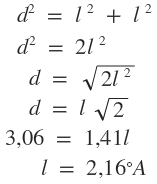
Portanto, com base neste cálculo e na figura ilustrativa, podemos concluir que o lado do quadrado que compõe a base da figura é igual ao lado (ou aresta) de todos os triângulos que formam o octaedro.
Assim, a medida da aresta desse octaedro, em oA, é aproximadamente igual a 2,16 ºA.
Alternativa correta, C.

Deixe um comentário