Continua após a publicidade..
Observe a célula eletroquímica:
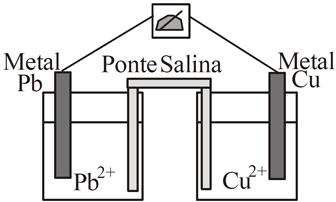
Considerando os potenciais:
Pb+2 + 2e → Pb (E° = -0,13V)
Cu+2 + 2e → Cu (E° = +0,34V),
Podemos afirmar corretamente sobre esta célula que:
Cu+2 + 2e → Cu (E° = +0,34V),
Podemos afirmar corretamente sobre esta célula que:
- A) o eletrodo de chumbo é o catodo, e a ddp da pilha é -0,47V.
- B) o eletrodo de chumbo é o anodo, e a ddp da pilha é +0,47V.
- C) a transferência de elétrons se dá do cobre para o chumbo porque E°Cu > E°Pb.
- D) a ddp da pilha é +0,21V, e a oxidação ocorre no eletrodo Cu/Cu+2.
- E) a reação global espontânea da pilha é Pb+2 + Cu → Cu+2 + Pb (Δ o anodo é o E° = -0,47
Resposta:
A alternativa correta é letra B
Analisando as semi-reações de redução e os potenciais-padrão de cada espécie, pode-se dizer que na célula eletroquímica esquematizada, o ânodo é o eletrodo de chumbo, já que sofre oxidação; e o cátodo é o de cobre, pois sofre redução. A diferença de potencial da célula é dado abaixo:
d.d.p. = E° cátodo - E° ânodo
d.d.p. = +0,34 - (-0,13)
d.d.p. = + 0,47V
Portanto, a resposta correta é a alternativa B.

Deixe um comentário