Continua após a publicidade..
Dois copos (A e B) contêm solução aquosa de nitrato de prata e nitrato de cobre respectivamente, e estão conectados entre si por uma ponte salina. Montou-se uma pilha então constituída de prata e cobre, mergulhados em suas soluções, como na figura.
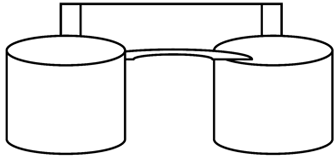
Ag = +0,80V (Ered) Cu = + 0,34V (Ered)
Qual das afirmativas está errada?
- A) Ao se fechar o circuito, haverá um fluxo de elétrons do eletrodo de cobre para o eletrodo de prata.
- B) Ao se fechar o circuito, observará a diminuição da massa do cobre.
- C) Ao se fechar o circuito, haverá um fluxo de elétrons do eletrodo de prata para o eletrodo de cobre.
- D) O cátodo é a prata.
- E) Ocorrera aumento da massa de prata.
Resposta:
A alternativa correta é letra C
Observando o potencial de redução dos dois metais, nota-se que quando o circuito for fechado, a prata reduzirá, enquanto que o cobre se oxidará. Dessa forma, o cobre doará elétrons para a redução dos cátions de prata presentes na solução, sendo o fluxo de elétrons do eletrodo de cobre para o de prata. Também, haverá a perda de massa do eletrodo de cobre e aumento no de prata.
Sendo assim, a resposta correta é a alternativa C.

Deixe um comentário