Continua após a publicidade..
O gás cloreto de carbonila, COCl2 (fosgênio), extremamente tóxico, é usado na síntese de muitos compostos orgânicos. Conhecendo os seguintes dados coletados a uma dada temperatura:
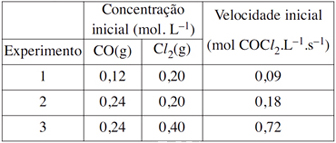
a expressão da lei de velocidade e o valor da constante k
de velocidade para a reação que produz o cloreto de carbonila,
CO(g) + Cl2(g) → COCl2(g), são, respectivamente:
de velocidade para a reação que produz o cloreto de carbonila,
CO(g) + Cl2(g) → COCl2(g), são, respectivamente:
- A) v = k [CO(g)]1 + [Cl2(g)]2, k = 0,56 L2.mol–2.s–1
- B) v = k [CO(g)]2 [Cl2(g)]1, k = 31,3 L2.mol–2.s–1
- C) v = k [Cl2(g)]2 , k = 2,25 L2.mol–2.s–1
- D) v = k [CO(g)]1 [Cl2(g)]2, k = 18,8 L2.mol–2.s–1
- E) v = k [CO(g)]1 [Cl2(g)]1, k = 0,28 L2.mol–2.s–1
Resposta:
A alternativa correta é letra D
A questão trata da ordem da reação em relação aos reagentes. Para a resolução, cada reagente deve ser considerado isoladamente e verificar como a velocidade da reação é alterada quando a concentração deste reagente é modificada.
Analisando os experimentos 1 e 2, nota-se que mantendo-se constante a concentração de Cl2 e dobrando-se a concentração de CO, dobra-se também a velocidade da reação, portanto a reação é de primeira ordem em relação ao CO.
Analisando os experimentos 2 e 3, nota-se que mantendo-se constante a concentração do CO e dobrando-se a concentração do Cl2, quadruplica-se a velocidade da reação, portanto, a reação é de segunda ordem em relação ao Cl2.
Conhecendo as ordens da reação em relação aos reagentes estabelecemos a lei da velocidade.
v = k [CO(g)]1 [Cl2(g)]2
Desse modo, é possivel calcular K, por :
v = k [CO(g)]1 [Cl2(g)]2 → k = v/[CO(g)]1 [Cl2(g)]2
K = (0,09)/(0,12)(0,20)2
k = 18,8 L2.mol–2.s–1
Portanto, a resposta correta é D

Deixe um comentário