Continua após a publicidade..
Observe o esquema abaixo:
Observe o esquema abaixo:
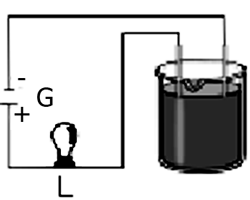
A força de um ácido é medida pelo seu grau de ionização (α), ou seja, pela relação entre o número de moléculas ionizadas e o número total de moléculas dissolvidas. Em qual das soluções, de mesma concentração e na mesma temperatura a lâmpada (L) do esquema apresenta maior brilho?
- A) HF
- B) HNO3
- C) H3PO4
- D) H2S
- E) H4SiO4
Resposta:
A alternativa correta é letra B
A questão aborda o conceito de força dos ácidos. Para que a lâmpada apresente maior brilho, é necessário uma maior quantidade de íons presentes na solução, para que possa haver uma maior corrente elétrica.
Assim, dentre os compostos citados, todos ácidos, o que apresenta maior força é o HNO3 , ácido considerado mais forte devido a regra geral de retirar o número de átomos de hidrogênio do número de átomos de oxigênio, como essa subtração resulta em 2, indica que o ácido é forte.
Nos outrso casos, o HF e H2S são hidrácidos fracos pelo fato de o oxigênio e o enxofre possuirem uma alta eletronegatividade.
Aplicando a regra de força de oxiácidos para o H3PO4 e H4SiO4, resulta em 1 e 0, indicando que são moderados e fraco, respectivamente.
Por isso, quando este está em solução, toda a quantidade de HNO3 presente se ioniza, liberando uma maior quantidade de íons do que os demais ácidos fracos mencionados nas outras alternativas, que se ionizam parcialmente.
Portanto a resposta correta é a alternativa B.

Deixe um comentário