Continua após a publicidade..
A sibutramina, cuja estrutura está representada, é um fármaco indicado para o tratamento da obesidade e seu uso deve estar associado a uma dieta e exercícios físicos.
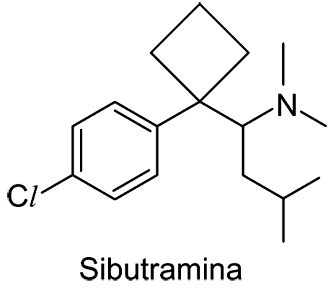
Com base nessa estrutura, pode-se afirmar que a sibutramina:
- A) é uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
- B) é um ácido de Brönsted-Lowry, porque possui um átomo de nitrogênio terciário.
- C) é um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
- D) é um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
- E) é uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
Resposta:
A alternativa correta é letra A
Para responder a esta questão, vamos utilizar as seguintes definições:
Ácido de Lewis: É uma espécie química aceptora de pares de elétrons.
Base de Lewis: É uma espécie química que doa pares de elétrons, para tanto deve ter ao menos um par de elétron não compartilhado.
Ácido de Bronsted-Lowry: Espécie química doadora de íons H+.
Base de Bronted-Lowry: Espécie química receptora de íons H+.
Ácido de Arrhenius: Substâncias que em solução aquosa geram íons H+.
Base de Arrhenius: Substâncias que em solução aquosa liberam íons OH-.
Com bases nestas definições, podemos então analisar as proposições:
a) é uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos. O átomo de N presente na estrutura realmente possui um par de elétron não compartilhado, podendo atuar como uma base de Lewis, pela definição.
b) é um ácido de Brönsted-Lowry, porque possui um átomo de nitrogênio terciário. O fato de possuir um nitrogênio terciário não define a substância como um ácido. Essa classificação não está de acordo com a definição de um ácido de Bronsted-Lowry.
c) é um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido. O átomo de nitrogênio da substância não está apto a receber par de elétron porque já possui seu octeto completo.
d) é um ácido de Arrhenius, porque possui um átomo de
nitrogênio capaz de doar próton. O átomo de Nitrogênio da substância não pode atuar como ácido de Arrhenius porque não apresenta H ionizável ligado diretamente a ele.
e) é uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido. Essa classificação não está de acordo com a definição de base de Lewis.
Portanto, a alternativa correta é A.

Deixe um comentário