Tendo a figura acima, que ilustra os níveis de organização na estrutura das proteínas, como referência, assinale a alternativa correta.
- A) Interações hidrofóbicas e eletrostáticas, ligações covalentes, pontes de hidrogênio e forças de Van der Waals são exemplos de interações entre cadeias laterais que estabilizam proteínas que apresentem o tipo de estrutura ilustrado na letra C.
- B) Proteínas multiméricas, constituídas pela estrutura ilustrada na letra D, são formadas por multissubunidades que dificultam a abertura e o fechamento de cavidades na superfície da molécula proteica.
- C) Supondo que uma proteína seja constituída pela estrutura representada na letra A, é correto afirmar que o número de aminoácidos, pouco variável, deverá facilitar as trocas de um aminoácido por outro sem que a atividade proteica seja afetada.
- D) Uma proteína com a estrutura representada na letra B deverá ser constituída de ligações covalentes, que promovem a estabilização dessa proteína.
- E) Se a estrutura da proteína ilustrada na letra C for submetida à ação de um agente físico desnaturante, como calor, luz ou frio, haverá perda de aminoácidos e, consequentemente, de toda a estrutura primária que estava presente.
Resposta:
A alternativa correta é letra A) Interações hidrofóbicas e eletrostáticas, ligações covalentes, pontes de hidrogênio e forças de Van der Waals são exemplos de interações entre cadeias laterais que estabilizam proteínas que apresentem o tipo de estrutura ilustrado na letra C.
Gabarito: Letra A.
a) Interações hidrofóbicas e eletrostáticas, ligações covalentes, pontes de hidrogênio e forças de Van der Waals são exemplos de interações entre cadeias laterais que estabilizam proteínas que apresentem o tipo de estrutura ilustrado na letra C.
Os níveis de organização na estrutura das proteínas representados na figura são: A= estrutura primária; B= estrutura secundária; C= estrutura terciária; e D= estrutura quaternária. Essa alternativa trata das ligações envolvidas no tipo de estrutura ilustrado na letra C, portanto, refere-se à estrutura terciária.
A estrutura terciária pode ser entendida como a estrutura tridimensional de uma proteína, essa estrutura é resultante das interações entre os grupos R dos aminoácidos que compõem essa proteína. Entre as interações citadas na alternativa, a maioria são do tipo não covalente (ligações mais fracas) como as interações hidrofóbicas, interações eletrostáticas, pontes de hidrogênio e forças de Van der Waals. Sobre a ligação covalente (mais forte) que participa da formação da estrutura terciária das proteínas, podemos destacar a ligação dissulfeto que ocorre entre moléculas de enxofre. Abaixo um resumo das principais características das ligações não covalentes que foram citadas e ao final a estrutura geral dos aminoácidos:
- Interações hidrofóbicas: nesse tipo de interação os aminoácidos, de grupos hidrofóbicos R, se unem e formam uma região hidrofóbica na parte interna da proteína e uma região hidrofílica na parte externa dessa.
- Interações eletrostáticas (ligações iônicas): essa interação ocorre entre grupos R com cargas opostas, ou seja, um grupo R com carga positiva e outro com carga negativa.
- Pontes de hidrogênio: ocorre entre o oxigênio do grupo carboxila de um aminoácido e o hidrogênio do grupo amino de outro.
- Forças de Van der Waals: refere-se à força de atração entre moléculas, excluindo-se àquelas relacionadas a ligações covalentes ou interações eletrostáticas. Pode ser de três tipos: 1° - interação entre dois dipolos permanentes (Força de Keesom); 2° - interação entre um dipolo permanente e um polo induzido (Força de Debye); 3° interação entre dois dipolos instantaneamente induzidos (Força de dispersão London).
- Estrutura geral de um aminoácido: carbono alfa ligado a um átomo de hidrogênio, um grupo amino, um grupo carboxila e um grupo R (variável).
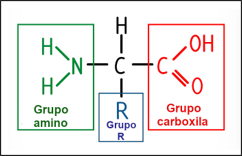
Fonte da imagem: https://static.mundoeducacao.uol.com.br/mundoeducacao/2020/12/estrutura-do-aminoacido.jpg. Acesso em 17/01/22.
Análise da demais alternativas:
b) Proteínas multiméricas, constituídas pela estrutura ilustrada na letra D, são formadas por multissubunidades que dificultam a abertura e o fechamento de cavidades na superfície da molécula proteica.
INCORRETA.
As multissubunidades permitem que ocorra uma rápida abertura e fechamento de cavidades na superfície da molécula proteica, na maioria dos casos esses processos estão relacionados com a função da proteína, portanto, as multissubunidades não podem dificultá-los.
c) Supondo que uma proteína seja constituída pela estrutura representada na letra A, é correto afirmar que o número de aminoácidos, pouco variável, deverá facilitar as trocas de um aminoácido por outro sem que a atividade proteica seja afetada.
INCORRETA.
A estrutura representada na letra A é a estrutura primária, essa corresponde a sequência linear dos aminoácidos, unidos por meio de ligações peptídicas. A troca de um aminoácido por outro pode alterar a atividade proteica, podemos citar como exemplo a anemia falciforme, uma doença hereditária que afeta as hemácias, que ocorre devido a alteração de um único aminoácido.
d) Uma proteína com a estrutura representada na letra B deverá ser constituída de ligações covalentes, que promovem a estabilização dessa proteína.
INCORRETA.
A estrutura representada na letra B é a estrutura secundária, sendo os dois tipos mais comuns, α-hélice e a folha-β pregueada, mantidas por meio de ligações de hidrogênio, um tipo de ligação não covalente.
e) Se a estrutura da proteína ilustrada na letra C for submetida à ação de um agente físico desnaturante, como calor, luz ou frio, haverá perda de aminoácidos e, consequentemente, de toda a estrutura primária que estava presente.
INCORRETA.
A desnaturação promove a alteração na estrutura tridimensional da proteína, afetando sua atividade. Entretanto, a desnaturação não promove a perda de aminoácidos, ou seja, a estrutura primária é mantida.

Deixe um comentário