Analise os gráficos de Lineweaver-Burk (duplos-recíprocos) a seguir, nos quais a linha cheia indica a reação na ausência de inibidor e a linha tracejada indica a presença de uma concentração fixa do inibidor. Em seguida, assinale a alternativa correta.
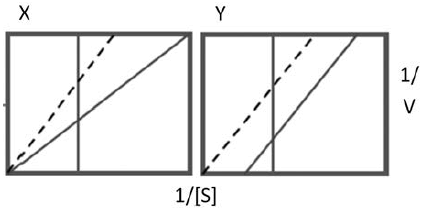
- A) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico, formando complexo EI, e o Y uma inibição irreversível.
- B) o gráfico X mostra uma inibição competitiva, onde o inibidor compete com o substrato e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
- C) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga ao mesmo sítio que o substrato, e o Y uma inibição mista, onde o inibidor se liga a um sítio distinto do sítio catalítico, sem formar complexos.
- D) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico formando o complexo EI, e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
- E) O gráfico X mostra uma inibição irreversível, onde o inibidor se liga covalentemente à enzima, e o Y uma inibição competitiva, onde o inibidor compete com o substrato.
Resposta:
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
As representações de gráficos de Lineweaver-Burk (duplos-recíprocos) para a atividade enzimática com ou sem inibidores (que podem ser do tipo competitivo ou não competitivo) estão representadas na figura abaixo:
Concluímos que em X temos um caso de inibidor não competitivo e em Y temos um caso de inibidor competitivo.
Os inibidores competitivos retardam o progresso da reação ao se ligar à enzima, geralmente no sítio ativo.
Os inibidores não competitivos não impedem que o substrato se ligue à enzima, porém, quando o inibidor está ligado, a enzima não consegue catalisar sua reação para produzir um produto.
Vamos analisar as alternativas apresentadas.
a) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico, formando complexo EI, e o Y uma inibição irreversível.
ERRADO. Em X temos a ligação de um inibidor não competitivo, que se liga em sitio catalítico distinto do sítio catalítico e impede a enzima de realizar seu trabalho. Em Y não temos um inibidor irreversível.
b) o gráfico X mostra uma inibição competitiva, onde o inibidor compete com o substrato e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
ERRADO. Em X temos a ligação de um inibidor não competitivo.
c ) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga ao mesmo sítio que o substrato, e o Y uma inibição mista, onde o inibidor se liga a um sítio distinto do sítio catalítico, sem formar complexos. ERRADO. Em X temos a ligação de um inibidor não competitivo, que se liga em sitio catalítico distinto do sítio catalítico e impede a enzima de realizar seu trabalho.
d) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico formando o complexo EI, e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
ERRADO. Quanto a X tudo certo. Mas, em Y não temos inibição mista.
e) O gráfico X mostra uma inibição irreversível, onde o inibidor se liga covalentemente à enzima, e o Y uma inibição competitiva, onde o inibidor compete com o substrato.
ERRADO. Em X temos a ligação de um inibidor não competitivo, que se liga em sitio catalítico distinto do sítio catalítico e impede a enzima de realizar seu trabalho. Não é uma inibição irreversível. Quanto a Y, tudo certo.
Sem resposta correta, por isso, a anulação da questão.

Deixe um comentário