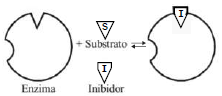
Inibidores competitivos são substâncias que competem diretamente com o substrato normal pelo sítio ativo das enzimas. A atividade da enzima tende a declinar por não ocorrer, plenamente, a formação do complexo enzima-substrato durante a existência do complexo enzima-inibidor. A ação do inibidor pode ser revertida aumentando-se a quantidade de substrato (S) na reação.
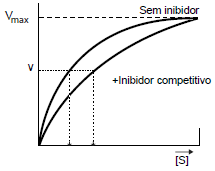
O gráfico demonstra a variação da velocidade de reação em relação à quantidade de substrato presente para os dois complexos mencionados.
MOTTA, Valter T. Bioquímica Básica. e. 2.
Rio de Janeiro: Medbook, 2011, p.36.
Com base nessas informações e nos conhecimentos de bioquímica, é correto afirmar:
- A) O inibidor competitivo reage com a enzima para formar um complexo enzima-inibidor análogo ao complexo enzima-substrato, embora cataliticamente ativo.
- B) Apenas o complexo enzima-substrato poderá alcançar a velocidade máxima, Vmax, de reação devido à ausência do inibidor nesse sistema.
- C) Em altas concentrações de substrato, S, todos os sítios ativos devem estar preenchidos com o substrato, o que justifica a velocidade máxima de reação observada em ambas as curvas no gráfico.
- D) Os inibidores competitivos são moléculas estruturalmente diferentes do substrato, apesar de apresentarem a mesma funcionalidade química.
- E) A ligação do inibidor competitivo com a enzima não bloqueia a ligação do substrato, mas provoca uma modificação da conformação da enzima que evita a formação do produto.
Resposta:
A alternativa correta é letra C) Em altas concentrações de substrato, S, todos os sítios ativos devem estar preenchidos com o substrato, o que justifica a velocidade máxima de reação observada em ambas as curvas no gráfico.
Com base nas informações do enunciado e nos conhecimentos de bioquímica:
a) O inibidor competitivo reage com a enzima para formar um complexo enzima-inibidor análogo ao complexo enzima-substrato, embora cataliticamente ativo.
INCORRETO: O inibidor pode se ligar à enzima livre formando um complexo enzima-inibidor, que é cataliticamente inativo, ou seja, o substrato não vai ser transformado no produto da reação.
b) Apenas o complexo enzima-substrato poderá alcançar a velocidade máxima, Vmax, de reação devido à ausência do inibidor nesse sistema.
INCORRETO: mesmo na presença do inibidor é possível alcançar a Vmax, pois a ação do inibidor pode ser revertida aumentando-se a quantidade de substrato (S) na reação.
c) Em altas concentrações de substrato, S, todos os sítios ativos devem estar preenchidos com o substrato, o que justifica a velocidade máxima de reação observada em ambas as curvas no gráfico.
CORRETO: a ação do inibidor pode ser revertida aumentando-se a quantidade de substrato (S) na reação.
d) Os inibidores competitivos são moléculas estruturalmente diferentes do substrato, apesar de apresentarem a mesma funcionalidade química.
INCORRETO: os inibidorores são moléculas estruturalmente semelhantes ao substrato, mas resistentes à ação da enzima, e competem com o substrato pelo centro ativo da enzima.
e) A ligação do inibidor competitivo com a enzima não bloqueia a ligação do substrato, mas provoca uma modificação da conformação da enzima que evita a formação do produto.
INCORRETO: no caso do inibidor competitivo, ocupa o mesmo sítio de ligação no substrato, impedindo a ligação da enzima. O inibidor alostérico/não competitivo é que provoca uma modificação da conformação da enzima que evita a formação do produto.

Deixe um comentário