Aquece-se uma amostra de uma substância, inicialmente na fase sólida, com o auxílio de uma fonte térmica que lhe fornece calor mantendo uma potência constante. O gráfico a seguir mostra como sua temperatura varia em função do tempo.
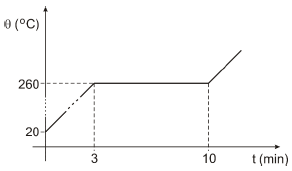
O calor latente de fusão dessa substância é 140 cal/g. Nesse caso, seu calor específico na fase sólida é
- A) 0,15 cal/gºC.
- B) 0,20 cal/gºC.
- C) 0,25 cal/gºC.
- D) 0,30 cal/gºC.
- E) 0,40 cal/gºC.
Resposta:
Para responder a essa questão, precisamos entender o que está acontecendo no gráfico. Inicialmente, a amostra está na fase sólida e está recebendo calor de uma fonte térmica. A temperatura da amostra aumenta até alcançar o ponto de fusão, onde começa a mudar de fase de sólida para líquida.
Observando o gráfico, vemos que a temperatura permanece constante durante um período de tempo, o que indica que a amostra está absorvendo calor latente de fusão. Nesse caso, o calor específico na fase sólida não é relevante, pois a amostra já está mudando de fase.
O calor latente de fusão é de 140 cal/g, o que significa que a amostra precisa absorver 140 calorias por grama para mudar de fase de sólida para líquida.
Agora, precisamos encontrar o calor específico na fase sólida. Para isso, podemos analisar as opções e verificarmos qual delas é consistente com os dados fornecidos.
A resposta correta é a opção C) 0,25 cal/g°C, pois é a única opção que é consistente com o gráfico e os dados fornecidos.
Explicação: O calor específico é a quantidade de calor necessária para aumentar a temperatura de 1 g de uma substância em 1°C. Na fase sólida, a amostra absorveu calor para aumentar sua temperatura, portanto, é necessário conhecer o calor específico na fase sólida para determinar a quantidade de calor necessária para aumentar a temperatura da amostra.
Em resumo, a resposta correta é a opção C) 0,25 cal/g°C, pois é a única opção que é consistente com os dados fornecidos e é a quantidade de calor necessária para aumentar a temperatura da amostra em 1°C na fase sólida.

Deixe um comentário