Em um experimento de calorimetria realizado no nível do mar, um estudante colocou 600 g de água a 10 ºC e 100 g de gelo a – 40 ºC em um calorímetro ideal, onde já existiam 800 g de água a 5 ºC, em equilíbrio térmico com o calorímetro.
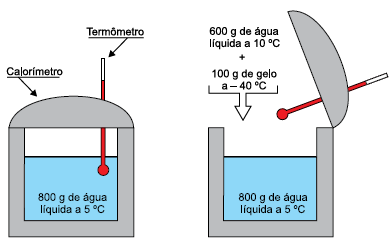
Sabendo que o calor específico da água líquida é 1 cal/(g · ºC), que o calor específico do gelo é 0,5 cal/(g · ºC) e que o calor latente de fusão do gelo é 80 cal/g, depois de atingido o novo equilíbrio térmico havia, dentro do calorímetro,
- A) 1 500 g de água líquida a 10 ºC.
- B) 1 450 g de água líquida e 50 g de gelo a 0 ºC.
- C) 1 500 g de gelo a – 5 ºC.
- D) 1 500 g de água líquida a 0 ºC.
- E) 1 500 g de gelo a 0 ºC.
Resposta:
A alternativa correta é letra D) 1 500 g de água líquida a 0 ºC.
Tanto a água que está à 5^circ C (porção de água 1) quanto a água à 10^circ C (porção de água 2) irão fornecer calor para a o gelo. O gelo irá aquecer até 0 ^circ C e caso haja diferença de temperatura entre as porções de água e de gelo a transferência de energia irá continuar.
Vamos incialmente calcular a quantidade de calor que o gelo deve absorver para aquecer até 0^circ C.
Q_1 = (m cdot c cdot Delta theta)_{mbox{gelo}}
Q_1 = 100 cdot 0,5 cdot [0-(-40)]
Q_1 = 50 cdot 40
Q_1 = 2,000mbox{ cal}
Calculando agora a quantidade de calor que as porções de água podem disponibilizar ao se resfriarem até 0^circ C.
Q_2 = (m cdot c cdot Delta theta)_{mbox{água 1}}+(m cdot c cdot Delta theta)_{mbox{água 2}}
Q_2 = 800 cdot 1cdot (0-5)+600 cdot 1 cdot (0-10)
Q_2 = -4,000 - 6,000
Q_2 = -10,000 mbox{ cal}
Analisando os resultados obtidos vemos que o gelo necessita de 2000 calorias para aquecer até 0 ^circ. As duas porções de água ao resfriarem perdem 10000 calorias (por isso o sinal negativo) e parte deste calor foi absorvido pelo gelo (2000 calorias) e parte ainda está disponível no sistema (8000 calorias).
Dando continuidade ao processo, temos agora 100 g de gelo à 0^circ C, 1400 g de água à 0^circ C e 8000 calorias disponíveis dentro do sistema. Com esse calor disponível a próxima etapa é a fusão do gelo. Calculando a energia necessária para a fusão do gelo:
Q_3 = mcdot L_f
Q_3 = 100 cdot 80
Q_3 = 8,000mbox{ cal}
Podemos ver que a quantidade de calor necessário para a fusão do gelo é exatamente a quantidade de energia disponível no sistema, sendo assim, o gelo irá derreter consumindo todo o calor disponível, restando apenas 1500 g de água líquida em equilíbrio térmico dentro do calorímetro.
Para confirmarmos o resultado, podemos escrever a equação do balanço energético, se o resultado for nulo, significa que o equilíbrio térmico foi atingido.
Q_{mbox{cedido}} + Q_{mbox{recebido}} = Q_1+Q_2+Q_3 = 2,000-10,000+8,000 = 0
Como o resultado obtido é zero, o equilíbrio térmico foi atingido.

Deixe um comentário