Um mol de um gás ideal monoatômico vai do estado a ao estado c, passando pelo estado b com pressão, como mostrado na figura abaixo. A quantidade de calor Q que entra no sistema durante esse processo é de aproximadamente:
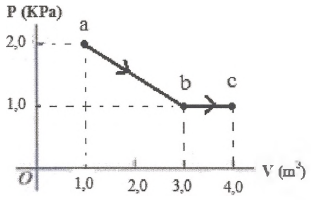
- A) 4000 J
- B) 5000 J
- C) 6000 J
- D) 7000 J
- E) 8000 J
Resposta:
A alternativa correta é letra D) 7000 J
O primeiro princípio da termodinâmica nos diz que:
Q = tau + Delta U
Onde (Q) é a quantidade de calor absorvida pelo sistema, (tau) o trabalho realizado e (Delta U) a variação da energia interna sofrida pelo gás.
O trabalho realizado pelo gás pode ser calculado através do gráfico de pressão em função do volume (P times V), sendo este numericamente igual à área abaixo da curva.
A figura geométrica abaixo da curva ab é um trapézio e abaixo da curva bc é um retângulo. Calculando as áreas das figuras:
tau_{ab} = A_1 = dfrac{(mbox{Base Maior}+mbox{ Base menor})times mbox{Altura}}{2}
tau_{ab}=dfrac{(2times 10^3+1times 10^3)times 2}{2}
bbox[8px, border: 1px solid black]{color{black}{tau_{ab} = 3,000mbox{ J}}}
tau_{bc} = A_2 = mbox{ Base} times mbox{ Altura}
tau_{bc} = 1 times (1times 10^3)
bbox[8px, border: 1px solid black]{color{black}{tau_{bc} = 1,000 mbox{ J}}}
O trabalho total realizado pelo gás na transformação de a para c (tau_{ac}) é:
tau_{ac}=tau_{ab}+tau_{bc}
tau_{ac} = 3,000+1,000
bbox[8px, border: 1px solid black]{color{black}{tau_{ac} = 4,000 mbox{ J}}}
A energia interna (U) para um gás ideal monoatômico pode ser calculada pela expressão:
U = dfrac{3PV}{2}
Calculando as energias internas para o estado inicial (U_a), estado final (U_c) e a variação da energia interna sofrida na transformação (Delta U_{ac}):
U_a = dfrac{3P_aV_a}{2}
U_a = dfrac{3times (2times 10^3) times 1}{2}
bbox[8px, border: 1px solid black]{color{black}{U_a = 3,000 mbox{ J}}}
U_c = dfrac{3P_cV_c}{2}
U_c = dfrac{3times (1times 10^3) times 4}{2}
bbox[8px, border: 1px solid black]{color{black}{U_c = 6,000 mbox{ J}}}
Delta U_{ac} = U_c-U_a
Delta U_{ac} = 6,000 – 3,000
bbox[8px, border: 1px solid black]{color{black}{Delta U_{ac} = 3,000 mbox{ J}}}
Aplicando o primeiro princípio da termodinâmica:
Q_{ac} = tau_{ac}+Delta U_{ac}
Q_{ac} = 4,000 + 3,000
Q_{ac} = 7,000 mbox{ J}
Portanto, a quantidade de calor que entra no sistema durante esse processo é de aproximadamente 7000 J.

Deixe um comentário