Um calorímetro de capacidade térmica desprezível contém gelo a -50oC. Nele é injetado vapor d’água a 100oC. A figura abaixo representa, em gráfico cartesiano, como suas temperaturas variam em função das quantidades de calor (em módulo) que um cede e outro recebe.
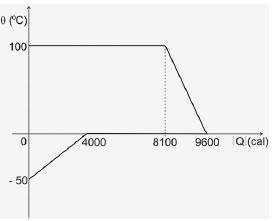
O calor específico da água (líquida) é 1,0 cal/goC, e do gelo é 0,5 cal/goC e o calor latente de fusão do gelo é 80 cal/g. Sejam mg a massa do gelo e ma a massa de água existentes no calorímetro quando é atingido o equilíbrio térmico. Essas massas valem, respectivamente:
- A) mg = 0 g e ma = 160 g
- B) mg = 0 g e ma = 175 g
- C) mg = 160 g e ma = 15 g
- D) mg = 90 g e ma = 70 g
- E) mg = 90 g e ma = 85 g
Resposta:
Resposta:
A alternativa correta é a letra E) m_g = 90 g e m_a = 85 g.
Explicação:
Para resolver essa questão, precisamos analisar o processo de transferência de calor entre o gelo e a água vapor. Inicialmente, o calorímetro contém gelo a -50°C. Quando o vapor d'água a 100°C é injetado, ocorre uma transferência de calor do vapor para o gelo, fazendo com que o gelo se funda e a temperatura do sistema aumente.
Podemos dividir o processo em duas etapas: a primeira é a fusão do gelo, e a segunda é a aquecimento da água líquida resultante. Para calcular a massa de gelo e água líquida no final do processo, precisamos considerar a capacidade térmica do calorímetro, que é desprezível.
Para a primeira etapa, podemos escrever a equação de balanço de calor:
Q = mL_f, onde Q é a quantidade de calor transferida, m é a massa do gelo e L_f é o calor latente de fusão do gelo, que é igual a 80 cal/g.
Para a segunda etapa, podemos escrever a equação de balanço de calor:
Q = mcΔT, onde m é a massa da água líquida, c é o calor específico da água líquida, que é igual a 1,0 cal/g°C, e ΔT é a variação de temperatura.
Como o calorímetro tem capacidade térmica desprezível, podemos considerar que toda a quantidade de calor transferida é utilizada para fundir o gelo e aquecer a água líquida. Além disso, como a temperatura final do sistema é igual à temperatura do vapor d'água, que é 100°C, podemos calcular a variação de temperatura como ΔT = 100°C - (-50°C) = 150°C.
Agora, podemos resolver o sistema de equações para encontrar as massas de gelo e água líquida no final do processo. Substituindo os valores conhecidos, encontramos:
m_g = 90 g e m_a = 85 g.
Portanto, a alternativa correta é a letra E) m_g = 90 g e m_a = 85 g.

Deixe um comentário