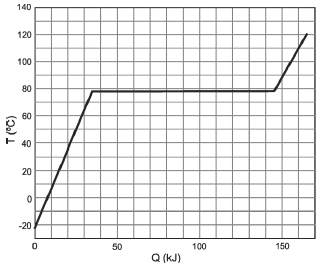
Em um recipiente termicamente isolado e mantido a pressão constante, são colocados 138 g de etanol líquido. A seguir, o etanol é aquecido e sua temperatura T é medida como função da quantidade de calor Q a ele transferida. A partir do gráfico de TxQ, apresentado na figura abaixo, pode-se determinar o calor específico molar para o estado líquido e o calor latente molar de vaporização do etanol como sendo, respectivamente, próximos de
- A) 0,12 kJ/(molºC) e 36 kJ/mol.
- B) 0,12 kJ/(molºC) e 48 kJ/mol.
- C) 0,21 kJ/(molºC) e 36 kJ/mol.
- D) 0,21 kJ/(molºC) e 48 kJ/mol.
- E) 0,35 kJ/(molºC) e 110 kJ/mol.
Resposta:
A alternativa correta é letra A) 0,12 kJ/(molºC) e 36 kJ/mol.
Pelo gráfico, percebemos que para uma variação de temperatura do etanol de Delta{theta}approx 100^o, C a quantidade de calor transferida foi de aproximadamente 35,kJ.
A massa molar do etanol (C_2H_5OH) é igual a 46g. Logo, 138g de etanol correspondem a 3 mols de etanol.
A Quantidade de calor recebida por uma substância para fazê-la ter uma elevação de temperatura é dada por:
Q = mcdot c cdot Delta (phi_f - phi_i) tag 1
Para encontramos o calor específico molar, deveremos usar, no lugar da massa em gramas, o número de mols:
35kJ=3cdot c cdot 100
c=frac{35kJ}{300}
capprox 0,1167,kJ/(mol^o,C)
Para determinarmos o calor latente de vaporização, deve-se lembrar que esse é o estágio onde não ocorrerá mudança de temperatura até que o etanol esteja totalmente vaporizado. A fórmula do calor latente é dada por:
Q=mL
Q=m_{molar}L
110,kJ=3L
L=frac{110,kJ}{3}
Lapprox 36,67,kJ/mol
Concluímos que o gabarito é a letra A.
Gabarito: A

Deixe um comentário