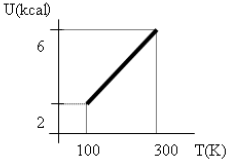
No gráfico abaixo está representada a variação de energia interna de 1 mol de um determinado gás, a volume constante, em função da temperatura. Os valores da variação da energia interna, quantidade de calor absorvido e trabalho realizado pelo gás são, respectivamente:
- A) 4,0 kcal, 4,0 kcal, nulo
- B) 3,0 kcal, 2,0 kcal, nulo
- C) 2,0 kcal, 5,0 kcal, 4,18 J
- D) 1,0 kcal, 2,0 kcal, nulo
- E) 2,0 kcal, 3,0 kcal, 4,18 J
Resposta:
A alternativa correta é letra E) 2,0 kcal, 3,0 kcal, 4,18 J
De acordo com a primeira lei da termodinâmica, temos que:
Delta U = Q - W
Onde Delta U é a variação da energia interna, Q é o calor absorvido e W é o trabalho realizado pelo gás. De acordo com o enunciado, o gráfico representa a variação da energia interna de um gás a volume constante. Assim, se não há variação no volume, não há realização de trabalho. Logo, com W = 0 na equação acima, temos que Delta U = Q. Isso significa que a variação de energia interna desse gás é igual ao calor absorvido.
Do gráfico, temos que U_{inicial} = 2 , kcal e U_{final} = 6 , kcal. Então, temos que:
Delta U = U_{final} - U_{inicial}
Delta U = 6-2
Delta U = 4 , kcal
Logo, como Q = Delta U, temos que Q = 4 , kcal.
Portanto, a resposta correta é a alternativa (A), Delta U = 4 , kcal, Q = 4 , kcal e W = 0.
Minha resposta: (A)
Gabarito: (E).

Deixe um comentário