Continua após a publicidade..
O diagrama de fases apresentado a seguir pertence a uma substância hipotética. Com relação a essa substância, pode-se afirmar que,
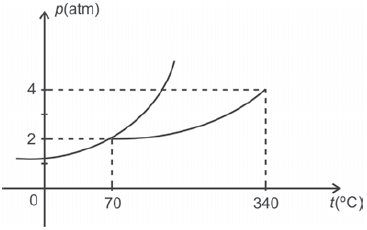
- A) nas condições normais de temperatura e pressão, a referida substância se encontra no estado sólido.
- B) se certa massa de vapor da substância à temperatura de 300ºC for comprimida lentamente, não poderá sofrer condensação pois está abaixo da temperatura crítica.
- C) para a temperatura de 0º C e pressão de 0,5 atm, a substância se encontra no estado de vapor.
- D) se aumentarmos gradativamente a temperatura da substância, quando ela se encontra a 70º C e sob pressão de 3 atm, ocorrerá sublimação da mesma.
Resposta:
Resposta: A alternativa correta é a letra C.
Explicação:
A resposta está relacionada ao diagrama de fases apresentado, figura. O diagrama de fases é uma representação gráfica que mostra as fases de uma substância em diferentes condições de temperatura e pressão.
No diagrama apresentado, podemos observar que, à temperatura de 0°C e pressão de 0,5 atm, a substância se encontra no estado de vapor. Isso ocorre porque, nessa temperatura e pressão, a substância está acima da curva de vaporização, que é a linha que separa as fases líquida e vapor.
Portanto, a afirmativa correta é a letra C, que diz que, à temperatura de 0°C e pressão de 0,5 atm, a substância se encontra no estado de vapor.
As outras opções estão erradas porque:
- A opção A está errada porque, nas condições normais de temperatura e pressão, a substância não se encontra no estado sólido.
- A opção B está errada porque, mesmo que a substância seja comprimida lentamente a 300°C, ela não pode sofrer condensação pois está acima da temperatura crítica.
- A opção D está errada porque, aumentando gradualmente a temperatura da substância, quando ela se encontra a 70°C e sob pressão de 3 atm, não ocorre sublimação.

Deixe um comentário