Uma amostra de um gás ideal realiza uma sequência de transformações termodinâmicas (AB, BC, CD e DA) conforme o gráfico pressão (P) em função do volume (V) a seguir.
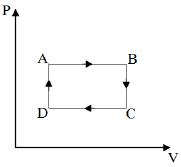
Assinale a alternativa que indica corretamente as transformações termodinâmicas pelas quais a energia interna da amostra aumentou.
- A) DA e CD
- B) AB e BC
- C) AB e DA
- D) BC e CD
Resposta:
A alternativa correta é letra C) AB e DA
Gabarito: LETRA C.
Para resolver a questão, devemos lembrar que um gás perfeito é um sistema ideal que obedece a lei geral dos gases ideais, descrita na equação a seguir:
dfrac {PV}{T} = mathrm{constante} tag 1
Onde P é a pressão, V é o volume e T é a temperatura do sistema.
Além disso, devemos lembrar também que a energia interna de um gás está relacionada com a temperatura de forma que quando há um aumento da temperatura, ocorre o aumento da energia interna e quando a temperatura diminui, a energia interna também diminui.
No processo AB, o gás sofre uma expansão (V_B gt V_A) a pressão constante. Da equação (1), temos que volume e temperatura são diretamente proporcionais. Assim, no processo AB o aumento de volume a pressão constante provoca um aumento na temperatura e, consequentemente, um aumento na energia interna do sistema.
No processo BC, o gás sofre uma diminuição de pressão (P_C lt P_B) a volume constante. Da equação (1), temos que pressão e temperatura também são diretamente proporcionais. Assim, no processo BC, a diminuição de pressão a volume constante provoca uma diminuição na temperatura e, consequentemente, uma diminuição na energia interna do sistema.
No processo CD, ocorre o inverso do processo AB, ou seja, há uma diminuição de a pressão constante. Logo, há uma diminuição na energia interna do sistema.
No processo DA, ocorre o inverso do processo BC, ou seja, há um aumento de pressão a volume constante. Logo, há um aumento na energia interna do sistema.
Portanto, a resposta correta é a alternativa (C).

Deixe um comentário