Analise o diagrama PV abaixo.
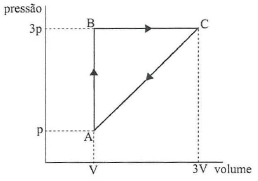
A figura acima exibe, num diagrama PV, um ciclo reversível a que está submetido 2 moles de um gás monoatômico ideal. Sabendo que as temperaturas nos estados A, B e C estão relacionadas por T_c = 3T_B = 9T_A, qual a eficiência do ciclo?
- A) 1/3
- B) 1/5
- C) 1/6
- D) 1/7
- E) 1/9
Resposta:
A alternativa correta é letra E) 1/9
A eficiência de uma máquina térmica é dada por:
eta = dfrac{mbox{Trabalho}}{mbox{Calor Absorvido}}=dfrac{tau}{Q} tag{1}
Para o cálculo do trabalho, podemos calcular a área da figura formada no diagrama (pressão x volume). O trabalho será numericamente igual à área calculada. Logo:
tau = mbox{Área triângulo} = dfrac{mbox{base} times mbox{altura}}{2}
tau = dfrac{2V times 2p}{2}
tau = 2pV
Para o cálculo do calor absorvido, devemos recordar que para gases monoatômicos ideias valem as relações:
mbox{Transformação à volume constante} rightarrow , Q = C_V cdot Delta T
mbox{Transformação à Pressão constante} rightarrow Q = C_p cdot Delta T
Onde :
C_V = dfrac{3}{2}nR
C_p = dfrac{5}{2}nR
No trecho AB temos uma transformação à volume constante (isométrica). Aplicando a equação para o cálculo do calor:
Q_{AB} = dfrac{3}{2} n R cdot Delta T_{AB}
Como:
pV = nRT ;;; implies T = dfrac{pV}{nR}
Podemos substituir na equação acima:
Q_{AB} = dfrac{3}{2} n R cdot Delta T_{AB}
Q_{AB} = dfrac{3}{2} n R cdot Delta left(dfrac{pV}{nR}right)_{AB}
No trecho AB, temos V, n e R constantes, logo podemos tirar de dentro da variação (Delta):
Q_{AB} = dfrac{3}{2} n R cdotDelta left(dfrac{pV}{nR}right)_{AB}
Q_{AB} = dfrac{3}{2} n R cdot left(dfrac{V}{nR}right)cdot Delta p_{AB}=dfrac{3}{2} cancel{n R} cdot left(dfrac{V}{cancel{nR}}right)cdot Delta p_{AB}
Q_{AB}=dfrac{3V(p_B-p_A)}{2}
Q_{AB}=dfrac{3V(3p-p)}{2}
bbox[8px, border: 1px solid black]{color{black}{Q_{AB} = 3pV}}
Agora para o trecho BC, temos uma transformação à pressão constante. Calculando o calor absorvido:
Q_{BC} = dfrac{5}{2}nR cdot Delta T_{BC}
Q_{BC} = dfrac{5}{2}nR cdot Delta left( dfrac{pV}{nR} right)_{BC}
Os termos p, n e R são constantes podem ser tirados do (Delta):
Q_{BC}= dfrac{5}{2}nR cdot left(dfrac{p}{nR}right)cdot Delta V_{BC} = dfrac{5}{2}cancel{nR} cdot left( dfrac{p}{cancel{nR}}right)cdot Delta V_{BC}
Q_{BC} = dfrac{5pcdot Delta V_{BC}}{2}= dfrac{5pcdot (V_C - V_B)}{2}
Substituindo os valores da pressão no trecho BC (p=3p) e os volumes VB e VC, temos:
Q_{BC}= dfrac{5(3p) (3V - V)}{2} = dfrac{30pV}{2}
bbox[8px, border: 1px solid black]{color{black}{Q_{BC} = 15pV}}
O calor total absorvido no trecho ABC é:
Q = Q_{AB}+Q_{BC}
Q = 3pV+15pV
bbox[8px, border: 1px solid black]{color{black}{Q = 18pV}}
Substituindo na equação (1):
eta = dfrac{tau}{Q}
eta = dfrac{2pV}{18pV}=dfrac{2bcancel{pV}}{18bcancel{pV}}=dfrac{2}{18}
bbox[8px, border: 2px solid #3498db]{color{#3498db}{eta = dfrac{1}{9}}}
Portanto a eficiência do ciclo é de color{#3498db}{ dfrac{1}{9}}.

Deixe um comentário