A experimentação é uma boa estratégia para o professor demonstrar fenômenos a seus alunos.
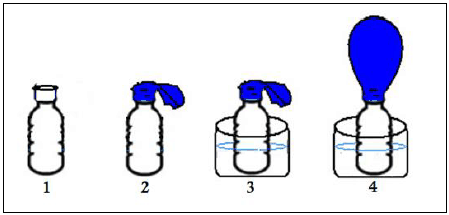
Pensando nisso, um professor aqueceu uma amostra de ar no interior de uma garrafa com um balão vazio encaixado em seu gargalo. O ar então se expandiu fazendo o balão dilatar. A seguir estão etapas do experimento:
A pressão do ar no interior da garrafa na situação final (garrafa no momento 4), em comparação à pressão atmosférica (externa), é:
- A) maior, porque o ar está em equilíbrio térmico com a sala.
- B) maior, porque o ar no interior da garrafa foi aquecido.
- C) menor, pois o ar não sofre expansão neste momento.
- D) menor, porque a água não aquece igualmente a garrafa e o balão.
- E) igual, pois o ar não sofre expansão neste momento.
Resposta:
A alternativa correta é letra B) maior, porque o ar no interior da garrafa foi aquecido.
De acordo com a teoria cinética dos gases, a pressão é o resultado das frequentes colisões entre as moléculas de um gás e as paredes do recipiente. O aumento da temperatura da garrafa faz com que as moléculas do vapor de água ganhem energia cinética e aumentem a pressão interna do gás no interior do balão. Assim, a pressão no interior da garrafa é maior.
Portanto, o gabarito da questão é a alternativa (B).

Deixe um comentário