Continua após a publicidade..
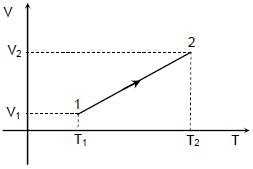
Um gás ideal sofre uma transformação isobárica. A transformação é ilustrada no diagrama V (volume) versus T (temperatura absoluta), apresentado na figura a seguir. Se Delta U, Q e W denotam, respectivamente, a variação da energia interna do gás, o calor por ele absorvido e o trabalho por ele realizado nessa transformação, então é possível afirmar que:
- A) Delta U > 0,~Q > 0~e~W > 0.
- B) Delta U > 0,~Q > 0~e~W = 0.
- C) Delta U = 0,~Q > 0~e~W > 0.
- D) Delta U = 0,~Q > 0~e~W = 0.
- E) Delta U > 0,~Q = 0~e~W > 0.
Resposta:
A alternativa correta é letra A) Delta U > 0,~Q > 0~e~W > 0.
ALTERNATIVA CORRETA: LETRA A
O trabalho do gás em uma transformação isobárica, depende exclusivamente do volume, como houve um aumento no volume, o trabalho foi positivo, tau ~>~0.
A variação de energia, depende apenas da Temperatura, como a temperatura se levou no processo a consequência é termos uma variação de energia positiva, Delta U ~>~0.
Através da 1ª Lei da Termodinâmica, Delta U = Q – tau, determinaremos o sinal do calor:
Q = Delta U + tau
Como a variação de energia e o trabalho são positivos, concluímos que o calor, será positivo, Q~>~0.
Delta U > 0,~Q > 0~e~W > 0
ALTERNATIVA CORRETA: LETRA A

Deixe um comentário