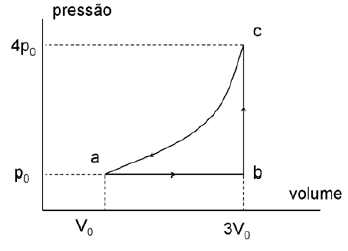
Um mol de um gás ideal monoatômico completa um ciclo como mostrado na figura abaixo. Sendo R = 8,314 J/mol.K a constante universal dos gases podemos afirmar que o trabalho realizado para expandir o gás de a até c pelo caminho abc e a variação da entropia no caminho abca valem, respectivamente:
- A) 2 V_0.p_0 e zero
- B) 2 V_0.p_0 e (3/2)Rln2
- C) 3 V_0.p_0 e zero
- D) 3 V_0.p_0 e (3/2)Rln2
- E) 4 V_0.p_0 e (3/2)Rln2
Resposta:
Resposta
A resposta certa é A) 2 V_0.p_0 e zero.
Explicação
Para resolver essa questão, precisamos entender o que está acontecendo no ciclo de transformação do gás ideal monoatômico.
Na figura, vemos que o gás realiza um ciclo que consiste em uma expansão isoterma (AB), seguida de uma compressão isobárica (BC) e, por fim, uma compressão isocórica (CA).
Para calcular o trabalho realizado durante a expansão isoterma, podemos usar a fórmula:
$$W = -nRT ln frac{V_f}{V_i}$$onde $n$ é o número de moles do gás, $R$ é a constante universal dos gases, $T$ é a temperatura em kelvin, $V_f$ é o volume final e $V_i$ é o volume inicial.
Como a temperatura é constante durante a expansão isoterma, o trabalho realizado é:
$$W = -2V_0.p_0$$onde $V_0$ é o volume inicial e $p_0$ é a pressão inicial.
Já para a variação da entropia, podemos usar a fórmula:
$$Delta S = nR ln frac{V_f}{V_i}$$Substituindo os valores, obtemos:
$$Delta S = 0$$Ou seja, a variação da entropia durante o caminho AB é zero.
Portanto, a resposta certa é A) 2 V_0.p_0 e zero.

Deixe um comentário