Continua após a publicidade..
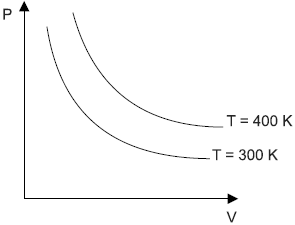
O gráfico a seguir mostra a Pressão (P) em função do Volume (V) em duas transformações de um gás ideal. Adotando C = nRT, em que n é o número de moles do gás, R é a constante universal dos gases, e T é a temperatura do gás em cada transformação, a função correspondente à relação entre P e V nessas duas curvas é
- A) P = C V
- B) P = C/V
- C) P = C/V2
- D) P = CV2
- E) P = C/V3
Resposta:
A alternativa correta é letra B) P = C/V
O gráfico descreve curvas que representam transformações isotérmicas - isotermas.
A equação de Clapeyron relaciona as grandezas envolvidas em uma transformação gasosa.
P cdot V = n cdot R cdot T
Em uma transformação isotérmica n cdot R cdot T permanecerá constante, portanto a relação entre P e V será dada por:
P cdot V = constante
P cdot V = C
P = {C over V}
Resposta: Alternativa B

Deixe um comentário