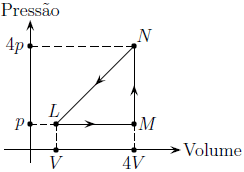
Um recipiente contém um gás monoatômico ideal inicialmente no estado L, com pressão p e volume V . O gás é submetido a uma transformação cíclica LMNL, absorvendo de uma fonte quente uma quantidade de calor Q_1 e cedendo a uma fonte fria uma quantidade de calor Q_2. Pode-se afirmar que Q_1 é igual a
- A) 30pV
- B) 51pV/2
- C) 8pV
- D) 15pV/2
- E) 9pV/2
Resposta:
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
De acordo com o diagrama PxV, o ciclo é realizado no sentido anti-horário. Dessa forma, o gás recebe trabalho externo e absorve calor da fonte fria e cede calor à fonte quente, funcionando como um refrigerador. Por isso, a questão foi anulada.
Se considerarmos que Q_1 é a quantidade de calor absorvida, podemos afirmar que Q_1 é responsável pelo processo L rightarrow M rightarrow N. Assim, temos:
Delta U_{L rightarrow M rightarrow N} = Q_{1} - W_{L rightarrow M rightarrow N}
Delta U_{L rightarrow M rightarrow N} = Q_{1} - W_{L rightarrow M rightarrow N}
Para um gás monoatômico, temos que:
Delta U = dfrac {3 nR Delta T }{2}
Então,
Delta U_{L rightarrow M rightarrow N} = Q_{1} - W_{L rightarrow M rightarrow N}
dfrac {3 nR (T_N - T_L) }{2} = Q_{1} - (4V -V)cdot p
dfrac {3 nR (T_N - T_L) }{2} = Q_{1} - 3pV
De acordo com a lei geral dos gases ideais, temos:
dfrac {P_N V_N}{T_N} =dfrac {P_L V_L}{T_L}
dfrac {4p cdot 4V}{T_N} =dfrac {p V}{T_L}
T_N = 16 T_L
Então,
dfrac {3 nR (16 T_L - T_L) }{2} = Q_{1} - 3pV
dfrac {3 nR (16 T_L - T_L) }{2} = Q_{1} - 3pV
dfrac {3 nR (15 T_L ) }{2} = Q_{1} - 3pV
dfrac {45 nR T_L }{2} = Q_{1} - 3pV
Como P_L V_L = nrT_L, temos:
dfrac {45 P_L V_L }{2} = Q_{1} - 3pV
dfrac {45 pV }{2} = Q_{1} - 3pV
Q_{1} = dfrac {45 pV }{2} + 3pV
Q_{1} = dfrac {51pV }{2}
Portanto, a quantidade de calor absorvida é dfrac {51pV }{2}.
Resposta: anulada.

Deixe um comentário