Prova de Química da Fuvest 2017 Resolvida
Questão 1

Na impressão de esferas maciças idênticas de 12,6 g, foram consumidos, para cada uma, 50 m desse polímero, na forma de fios cilíndricos de 0,4 mm de espessura. Para uso em um rolamento, essas esferas foram tratadas com graxa. Após certo tempo, durante a inspeção do rolamento, as esferas foram extraídas e, para retirar a graxa, submetidas a procedimentos diferentes. Algumas dessas esferas foram colocadas em um frasco ao qual foi adicionada uma mistura de água e sabão (procedimento A), enquanto outras esferas foram colocadas em outro frasco, ao qual foi adicionado removedor, que é uma mistura de hidrocarbonetos líquidos (procedimento B).
a) Em cada um dos procedimentos, A e B, as esferas ficaram no fundo do frasco ou flutuaram? Explique sua resposta.
b) Em qual procedimento de limpeza, A ou B, pode ter ocorrido dano à superfície das esferas? Explique.

a)
Para determinar se as esfereras ficam no fundo do frasco ou flutuam é preciso calcular a densidade. Para isso, calcula-se primeiro o volume do fio utilizado na impressão de uma esfera:
Cálculo da densidade
Como a densidade da esfera é maior que as densidades da água com sabão e do removedor, as esferas ficam no fundo do recipiente nos dois experimentos.
b)
O procedimento B utiliza um remover constituído de hidrocarbonetos líquido, que interagem bem com substâncias apolares. Como o polímero apresentado tem caráter apolar, a mistura de hidrocarbonetos pode dissolver as esferas e causar dano em suas superfícies.
Questão 2
a) Calcule a energia liberada na combustão de um quilograma dessa amostra de biogás.
b) Calcule o ganho de energia, por quilograma, se for utilizado biogás totalmente isento de impurezas, em lugar da amostra que contém os outros gases.
c) Além de aumentar o poder calorífico, a purificação do biogás representa uma diminuição do dano ambiental provocado pela combustão. Explique por quê.
d) Em aterros sanitários, ocorre a formação de biogás, que pode ser recolhido. Em um aterro sanitário, tubos foram introduzidos para captação dos gases em duas diferentes profundidades, como é mostrado na figura. Em qual dos tubos, A ou B, é recolhido biogás com maior poder calorífico? Explique.


a) Calcule a energia liberada na combustão de um quilograma dessa amostra de biogás.
Em 1000 gramas (1kg) de biogás temos 640 g de CH4 e 40 g de H2S.
Se 1000 gramas (1kg) de CH4 libera 55.000 kJ, então 640g libera:
Se 1000 gramas (1kg) de H2S libera 15.000 kJ, então 40g libera:
O total de energia liberado é de 600 + 35.200 = 35.800 kJ
b) Calcule o ganho de energia, por quilograma, se for utilizado biogás totalmente isento de impurezas, em lugar da amostra que contém os outros gases.
O biogás livre de impurezas seria composto apenas por CH4, a combustão de 1kg de CH4 libera 55.000kJ, portanto haveria um ganho energético de:
55.000 – 35.800 = 19.200kJ por kg de biogás.
c) Além de aumentar o poder calorífico, a purificação do biogás representa uma diminuição do dano ambiental provocado pela combustão. Explique por quê.
O H2S presente no biogás forma SO2 como produto de sua combustão, um óxido ácido resposável pela formação de chuvas ácidas que causam danos ambientais.
d) Em aterros sanitários, ocorre a formação de biogás, que pode ser recolhido. Em um aterro sanitário, tubos foram introduzidos para captação dos gases em duas diferentes profundidades, como é mostrado na figura. Em qual dos tubos, A ou B, é recolhido biogás com maior poder calorífico? Explique.
Quanto mais fundo no solo menor é o contato com o oxigênio, com isso ocorre maior decomposição anaeróbica, que favorece a formação de biogás cada vez mais puro (maior teor de CH4), que tem maio poder calorífico, portanto no tubo A.
3) No preparo de certas massas culinárias, como pães, é comum adicionar-se um fermento que, dependendo da receita, pode ser o químico, composto principalmente por hidrogenocarbonato de sódio (NaHCO3), ou o fermento biológico, formado por leveduras. Os fermentos adicionados, sob certas condições, são responsáveis pela produção de dióxido de carbono, o que auxilia a massa a crescer.
- A) I e II.
- B) II e III.
- C) III e IV.
- D) I, II e IV.
- E) I, III e IV.
A alternativa correta é letra B)
I. Incorreta. Apenas as leveduras presentes no fermento biológico consomem os carboidratos presentes na massa culinária com produção de .
II. Correta. A termodecomposição do pode ser representada pela equação:
III. Correta. As leveduras presentes no fermento biológico realizam fermentação e consomem os carboidratos, produzindo .
IV. Incorreta. Apenas o fermento químico necessita de temperaturas elevadas para a produção de , já que, nesse caso, a reação de termodecomposição depende de temperaturas elevadas.
Questão 4

Sendo assim, a fórmula estrutural da dopamina é:
- A)

- B)

- C)

- D)

- E)

A alternativa correta é letra E)
Pelo modelo de reação apresentado, tem-se:

Questão 5

A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo, é

- A) 3,32.
- B) 6,43.
- C) 12,9.
- D) 386.
- E) 772.
A alternativa correta é letra B)

Reação anódica:
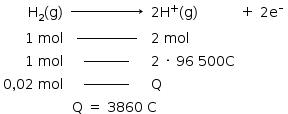
Cálculo da corrente:
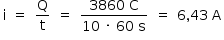
Questão 6
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:

Considerando a equação química que representa a transformação global desse processo, as lacunas da frase “No intemperismo sofrido pela pirita, a razão entre as quantidades de matéria do FeS2 (s) e do O2 (g) é __________, e, durante o processo, o pH do solo __________” podem ser corretamente preenchidas por
- A) 1/4; diminui.
- B) 1/4; não se altera.
- C) 2/15; aumenta.
- D) 4/15; diminui.
- E) 4/15; não se altera.
A alternativa correta é letra D)
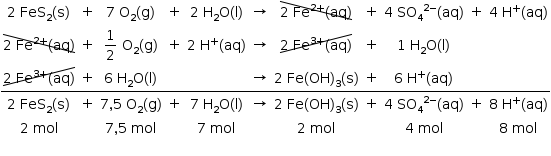
Razão entre as quantidades de matéria de FeS2 e O2:
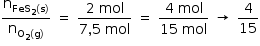
Como a reação global libera H+, o pH do solo diminui.
Questão 7

Para que o solo possa fornecer todos os elementos citados na tabela, o seu pH deverá estar entre
- A) 4 e 6.
- B) 4 e 8.
- C) 6 e 7.
- D) 6 e 11.
- E) 8,5 e 11.
A alternativa correta é letra C)
O pH ideal para a absorção dos nutrientes seria entre 6 e 7 no qual todos os nutrientes se encontram na forma solúvel, necessária para que possa realmente ocorrer a absorção pelas plantas.
8) Nas mesmas condições de pressão e temperatura, 50 L de gás propano (C3H8) e 250 L de ar foram colocados em um reator, ao qual foi fornecida energia apenas suficiente para iniciar a reação de combustão. Após algum tempo, não mais se observou a liberação de calor, o que indicou que a reação havia-se encerrado. Com base nessas observações experimentais, três afirmações foram feitas:
- A) I.
- B) III.
- C) I e II.
- D) I e III.
- E) II e III.
A alternativa correta é letra D)
I. Se tivesse ocorrido apenas combustão incompleta, restaria propano no reator.
Correto.
Reação de combustão incompleta do propano:
1 mol de C3H8 ________ 3,5 mol de O2
Como gases ideais nas mesmas condições de temperatura e pressão possuem o mesmo volume molar, para reagir com 1 L de C3H8 são necessários 3,5 L de O2. A partir disso pode-se calcular a quantidade de O2 necessária para reagir com 50 L de C3H8:
1 L de C3H8 ________ 3,5 L de O2
50 L de C3H8 ________ X L de O2
X = 175 L de O2
Cálculo da quantidade de O2 em 250 L de ar:
250 L de ar ________ 100%
Y L de O2 ________ 20%
Y = 50 L de O2
É necessário 175 L de O2 para reagir completamente com 50L de propano. Entretanto, como está disponível apenas 50L de O2, o O2 é o reagente limitante e o propano é o reagente em excesso.
Como o propano está em excesso, ao fim da reação ainda sobra propano no reator.
O mesmo é válido para a outra reação de combustão incompleta que pode acontecer:
II. Para que todo o propano reagisse, considerando a combustão completa, seriam necessários, no mínimo, 750 L de ar.
Incorreto.
Reação de combustão completa
1 mol de C3H8 ________ 5 mol de O2
Como gases ideais nas mesmas condições de temperatura e pressão possuem o mesmo volume molar, para reagir com 1L de C3H8 são necessário 5L de O2. A partir disso pode-se calcular a quantidade de O2 necessária para reagir com 50L de C3H8:
1 L de C3H8 ________ 5 L de O2
50 L de C3H8 ________ W L de O2
W = 250L de O2
250 L de O2 equivalem a 20% do volume do ar. Portanto, o volume de ar que contém 250L de O2 é Z:
250 L de O2 ________ 20% de ar
Z L de O2 ________ 100% de ar
Z = 1250L de ar
III. É provável que, nessa combustão, tenha se formado fuligem.
Correto.
Como se trata de uma reação de combustão em que oxigênio é o reagente limitante é esperado que ocorra reações de combustão incompleta (reação que ocorre quando o oxigênio é escasso) produzindo C(s) (fuligem) e CO(g) (monóxido de carbono).
Questão 9

Das alternativas apresentadas, a que representa o melhor material a ser aplicado ao vidro, de forma a evitar o acúmulo de água, é:

- A) CℓSi(CH3)2OH
- B) CℓSi(CH3)2O(CHOH)CH2NH2
- C) CℓSi(CH3)2O(CHOH)5CH3
- D) CℓSi(CH3)2OCH2(CH2)2CO2H
- E) CℓSi(CH3)2OCH2(CH2) 10 CH3
A alternativa correta é letra E)
Para evitar o acúmulo de água na superfície do vidro deve-se utilizar do material que possui maior caráter apolar. Dentre as opções, o material de maior caráter apolar é da alternativa E que possui a maior cadeia carbônica que não possui heteroátomos, formada apenas por carbono e hidrogênios.
Questão 10

Com base na figura e em seus conhecimentos, aponte a afirmação correta.
- A) Os setores econômicos de Construção e Produção de outras energias, juntos, possuem menores emissões de gases do efeito estufa antropogênicos do que o setor de Transporte, tendo como principal exemplo ocorrências no sudeste asiático.
- B) As maiores emissões de CH4 de origem antropogênica devem-se ao setor econômico da Agricultura e outros usos da terra, em razão das queimadas, principalmente no Brasil e em países africanos.
- C) As maiores emissões de gases do efeito estufa de origem antropogênica vinculadas à Produção de eletricidade e calor ocorrem nos países de baixo IDH, pois estes não possuem políticas ambientais definidas.
- D) Um quarto do conjunto de gases do efeito estufa de origem antropogênica lançados na atmosfera é proveniente do setor econômico de Produção de eletricidade e calor, em que predomina a emissão do CO2, ocorrendo com grande intensidade nos EUA e na China.
- E) A Indústria possui parcela significativa na emissão de gases do efeito estufa de origem antropogênica, na qual o N2O é o componente majoritário na produção em refinarias de petróleo do Oriente Médio e da Rússia.
A alternativa correta é letra D)
O gráfico de emissão de gases-estufa por setor econômico em 2010 evidencia que os setores eletricidade / geração de calor; e agricultura e outros usos eram os mais destacados em 25% e 24%, respectivamente. Assim, a melhor alternativa para a questão é aquela que mostra 1/4 das emissões de CO2 sendo produzidas pelo setor eletricidade / geração de calor, sendo que o EUA e China se sobressaem.
CORRETA D
