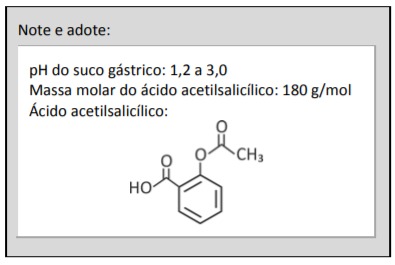
Muitos medicamentos analgésicos contêm, em sua formulação, o ácido acetilsalicílico, que é considerado um ácido fraco (constante de ionização do ácido acetilsalicílico = 3,2 x 10⁻⁴). A absorção desse medicamento no estômago do organismo humano ocorre com o ácido acetilsalicílico em sua forma não ionizada.
a) Escreva a equação química que representa a ionização do ácido acetilsalicílico em meio aquoso, utilizando fórmulas estruturais.
b) Escreva a expressão da constante de equilíbrio para a ionização do ácido acetilsalicílico. Para isto, utilize o símbolo AA para a forma não ionizada e o símbolo AA- para a forma ionizada.
c) Considere um comprimido de aspirina contendo 540 mg de ácido acetilsalicílico, totalmente dissolvido em água, sendo o volume da solução 1,5 L. Calcule a concentração, em mol/L, dos íons H+ nessa solução. Em seus cálculos, considere que a variação na concentração inicial do fármaco, devido à sua ionização, é desprezível.
d) No pH do suco gástrico, a absorção do fármaco será eficiente? Justifique sua resposta.
Resposta:
a) A equação da ionização está escrita abaixo.

b)
c) Podemos considerar que a concentração de e
será igual durante a ionização.
Substituindo este valor na equação da constante de equilíbrio poderemos achar a concentração de .
d) O fármaco é melhor absorvido na sua forma não ionizada. Em pH gástrico o equilíbrio será deslocado no sentido em que há consumo de já que o pH gástrico é ácido o que iria deslocar o equilíbrio para o sentido da espécie não ionizada.

Deixe um comentário