Prova de Química da Fuvest 2017 Resolvida
Questão 11
a) Escreva a equação química que representa a ionização do ácido acetilsalicílico em meio aquoso, utilizando fórmulas estruturais.
b) Escreva a expressão da constante de equilíbrio para a ionização do ácido acetilsalicílico. Para isto, utilize o símbolo AA para a forma não ionizada e o símbolo AA- para a forma ionizada.
c) Considere um comprimido de aspirina contendo 540 mg de ácido acetilsalicílico, totalmente dissolvido em água, sendo o volume da solução 1,5 L. Calcule a concentração, em mol/L, dos íons H+ nessa solução. Em seus cálculos, considere que a variação na concentração inicial do fármaco, devido à sua ionização, é desprezível.
d) No pH do suco gástrico, a absorção do fármaco será eficiente? Justifique sua resposta.
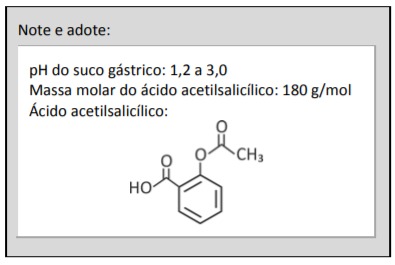
a) A equação da ionização está escrita abaixo.

b)
c) Podemos considerar que a concentração de e
será igual durante a ionização.
Substituindo este valor na equação da constante de equilíbrio poderemos achar a concentração de .
d) O fármaco é melhor absorvido na sua forma não ionizada. Em pH gástrico o equilíbrio será deslocado no sentido em que há consumo de já que o pH gástrico é ácido o que iria deslocar o equilíbrio para o sentido da espécie não ionizada.
Questão 12
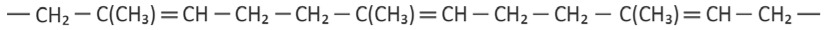
Em um avião, a temperatura dos pneus, recolhidos na fuselagem, era -13ºC durante o voo. Próximo ao pouso, a temperatura desses pneus passou a ser 27ºC, mas seu volume interno não variou.
a) Qual é a pressão interna de um dos pneus durante o voo? Mostre os cálculos.
b) Qual é o volume interno desse mesmo pneu, em litros, dado que foram utilizados 14 kg de N₂ para enchê-lo? Mostre os cálculos.
c) Escreva a fórmula estrutural do monômero do poli-isopreno.

a) Como o volume é mantido constante, podemos usar da equação de Charles e de Gay-Lussac para descobrir qual a pressão durante o voo.
b) Podemos utilizar da equação de Clapeyron para resolver este problema.
c) A fórmula do isopreno é a seguinte:

Questão 13
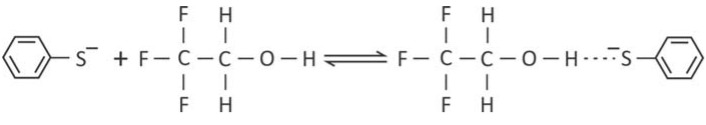
Para essa reação, foram determinados os valores da constante de equilíbrio em duas temperaturas distintas.
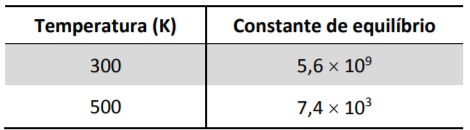
a) Essa reação é exotérmica ou endotérmica? Explique, utilizando os dados de constante de equilíbrio apresentados.
b) Explique por que, no produto dessa reação, há uma forte interação entre o átomo de hidrogênio do álcool e o átomo de enxofre do ânion.
a)
A consntate de equilíbrio de uma reação química (K) é calculada da seguinte forma:
Percebemos que com o aumento da temperatura o valor da constante de equilibrio diminuiu, dessa forma podemos concluir que a concentração de produtos também diminui . Assim, nota-se que a reação de conversão dos reagentes em produtos foi desfavorecida pelo aumento da temperatura, caracterísica de uma reação exotérmica.
b) A carga negativa do átomo de enxofre é atraída pela carga parcial positiva do átomo de hidrogênio nesse composto, os elétrons da ligação OH estão atráidos pela elétronegatividade do grupo CF3 e do prório oxigênio gerando as cargas parciais , como demonstrado abaixo:

Questão 14
a) Considere que apenas 30 % de todo o minério produzido em 2014 foram destinados ao processo de obtenção de níquel puro e que, nesse processo, a massa de níquel puro obtida correspondeu a 1,4 % da massa de minério utilizada. Calcule a massa mínima de carvão, em quilogramas, que foi necessária para a obtenção dessa quantidade de níquel puro
b) Cada um dos gases produzidos nessas etapas de obtenção do níquel puro causa um tipo de dano ambiental. Explique esse fato para cada um desses gases.

As reações descritas no texto são:
a) Primeiro calcula-se a massa de minério que foi destinada ao processo de obtenção de Ni puro.
—
—
Em seguida, calcula-se a massa de Ni puro obtida.
—
—
Agora calcula-se a massa de carvão utilizada usando da proporção das equações químicas que ocorrem no processo.
—
—
—
b) O é um dos principais causadores da chuva ácida enquanto que o
é um dos gases do efeito estufa e o aumento da sua concentração pode agravar este efeito fazendo com que as temperaturas da Terra fiquem cada vez mais altas.
Questão 15

Os dados obtidos nos três experimentos foram representados em um gráfico de volume de (CO₂) em função do tempo de reação. Esse gráfico está apresentado a seguir.
a) Escreva a equação química balanceada que representa a reação que ocorreu entre o carbonato de cobre e o ácido nítrico
b) Com base nas condições empregadas em cada experimento, complete a legenda do gráfico, na página de respostas, com o número do experimento. Considere irrelevante a perda de volume de (CO₂) coletado devido à dissolução na solução. Justifique suas resposta
c) Nos três experimentos, o mesmo reagente estava em excesso. Qual é esse reagente? Explique
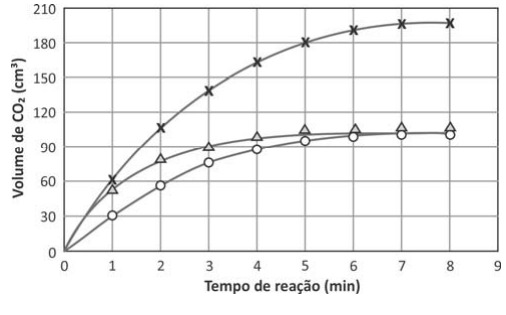
a)
b) Experimento 3 tem maior número de mols de ácido nítrico adcionados, logo produzirá mais CO2, experimento 1 e 2 produziram a mesma quantidade de CO2 por possuierem o mesmo números de mols de ácido nitrico entretanto no 1 a velocidade da reação é maior devido a maior concentração.

c) O reagente em execesso é o CuCO3 , é possível concluir isso graças ao experimento 3 que produziu mais CO2 apenas com adição de ácido nitrico , isso demonstra que quem estava limitando a reação era o ácido nítrico.
Questão 16
a) Complete, na página de respostas, a equação química que representa a reação de hidrólise do cloreto de terc-butila.
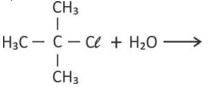
b) Explique por que a cor da solução se altera ao longo da reação.
O estudante repetiu a reação de hidrólise nas mesmas condições experimentais anteriormente empregadas, exceto quanto à composição do solvente. Nesse novo experimento, o cloreto de terc-butila foi solubilizado em uma mistura contendo 70 % de acetona e 30 % de água, em volume. Verificou que, para atingir a mesma coloração laranja observada anteriormente, foi necessário um tempo maior.
c) Explique por que a mudança da composição do solvente afetou o tempo de reação.

Reação de hidrólise:

b) Como ocorre a formação de ácido clorídrico durante a reação é possível concluir que o meio se acidificou , dessa forma o pH diminuiu.
c) Ao diminuir a concentração de um dos reagentes a velocidade da reação também diminuí, como nesse caso a água não é o solvente principal a velocidade da reação está relacionada a sua concentração, como sua concentração diminuíu a velocidade da reação também diminuíu,
