Para estudar a velocidade da reação entre carbonato de cobre (CuCO₃) e ácido nítrico (HNO₃), foram feitos três experimentos, em que o volume de dióxido de carbono (CO₂) produzido foi medido em vários intervalos de tempo. A tabela apresenta as condições em que foram realizados esses experimentos. Nos três experimentos, foram utilizadas massas idênticas de carbonato de cobre e a temperatura foi mantida constante durante o tempo em que as reações foram acompanhadas.

Os dados obtidos nos três experimentos foram representados em um gráfico de volume de (CO₂) em função do tempo de reação. Esse gráfico está apresentado a seguir.
a) Escreva a equação química balanceada que representa a reação que ocorreu entre o carbonato de cobre e o ácido nítrico
b) Com base nas condições empregadas em cada experimento, complete a legenda do gráfico, na página de respostas, com o número do experimento. Considere irrelevante a perda de volume de (CO₂) coletado devido à dissolução na solução. Justifique suas resposta
c) Nos três experimentos, o mesmo reagente estava em excesso. Qual é esse reagente? Explique
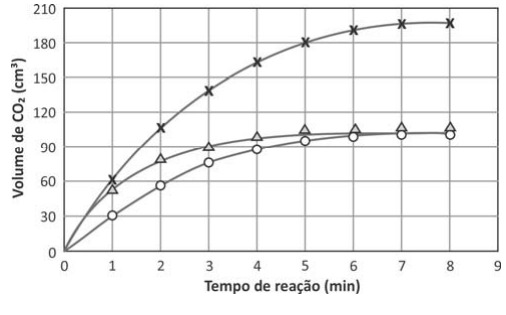
Resposta:
a)
b) Experimento 3 tem maior número de mols de ácido nítrico adcionados, logo produzirá mais CO2, experimento 1 e 2 produziram a mesma quantidade de CO2 por possuierem o mesmo números de mols de ácido nitrico entretanto no 1 a velocidade da reação é maior devido a maior concentração.

c) O reagente em execesso é o CuCO3 , é possível concluir isso graças ao experimento 3 que produziu mais CO2 apenas com adição de ácido nitrico , isso demonstra que quem estava limitando a reação era o ácido nítrico.

Deixe um comentário