Um estudante realizou em laboratório a reação de hidrólise do cloreto de terc-butila ((CH₃)₃CCℓ) para produzir terc-butanol. Para tal, fez o seguinte procedimento: adicionou 1 mL do cloreto de terc-butila a uma solução contendo 60 % de acetona e 40 % de água, em volume. Acrescentou, ainda, algumas gotas de indicador universal (mistura de indicadores ácido-base). Ao longo da reação, o estudante observou a mudança de cor: inicialmente a solução estava esverdeada, tornou se amarela e, finalmente, laranja.
a) Complete, na página de respostas, a equação química que representa a reação de hidrólise do cloreto de terc-butila.
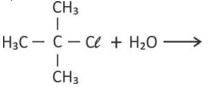
b) Explique por que a cor da solução se altera ao longo da reação.
O estudante repetiu a reação de hidrólise nas mesmas condições experimentais anteriormente empregadas, exceto quanto à composição do solvente. Nesse novo experimento, o cloreto de terc-butila foi solubilizado em uma mistura contendo 70 % de acetona e 30 % de água, em volume. Verificou que, para atingir a mesma coloração laranja observada anteriormente, foi necessário um tempo maior.
c) Explique por que a mudança da composição do solvente afetou o tempo de reação.

Resposta:
Reação de hidrólise:

b) Como ocorre a formação de ácido clorídrico durante a reação é possível concluir que o meio se acidificou , dessa forma o pH diminuiu.
c) Ao diminuir a concentração de um dos reagentes a velocidade da reação também diminuí, como nesse caso a água não é o solvente principal a velocidade da reação está relacionada a sua concentração, como sua concentração diminuíu a velocidade da reação também diminuíu,

Deixe um comentário