Uma das formas de se medir temperaturas em fase gasosa é por meio de reações com constantes de equilíbrio muito bem conhecidas, chamadas de reações-termômetro. Uma dessas reações, que ocorre entre o ânion tiofenolato e o 2,2,2-trifluoroetanol, está representada pela equação química
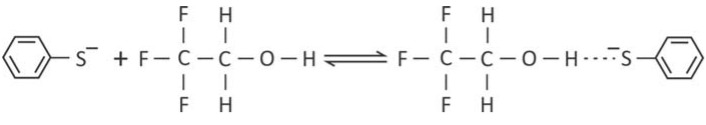
Para essa reação, foram determinados os valores da constante de equilíbrio em duas temperaturas distintas.
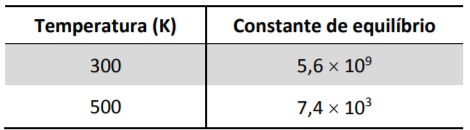
a) Essa reação é exotérmica ou endotérmica? Explique, utilizando os dados de constante de equilíbrio apresentados.
b) Explique por que, no produto dessa reação, há uma forte interação entre o átomo de hidrogênio do álcool e o átomo de enxofre do ânion.
Resposta:
a)
A consntate de equilíbrio de uma reação química (K) é calculada da seguinte forma:
Percebemos que com o aumento da temperatura o valor da constante de equilibrio diminuiu, dessa forma podemos concluir que a concentração de produtos também diminui . Assim, nota-se que a reação de conversão dos reagentes em produtos foi desfavorecida pelo aumento da temperatura, caracterísica de uma reação exotérmica.
b) A carga negativa do átomo de enxofre é atraída pela carga parcial positiva do átomo de hidrogênio nesse composto, os elétrons da ligação OH estão atráidos pela elétronegatividade do grupo CF3 e do prório oxigênio gerando as cargas parciais , como demonstrado abaixo:


Deixe um comentário