Prova de Química da Fuvest 2020 Resolvida
Questão 1
- Ao jogar o dado vermelho, o estudante deveria adicionar ao recipiente 100 mL de solução do ácido clorídrico na concentração 10−n mol/L,sendo n o número marcado no dado (por exemplo, se saísse o número 1 no dado, a solução seria de 10−1 mol/L; se saísse 6, a solução seria de 10−6 mol/L).
- Ao jogar o dado amarelo, o estudante deveria executar o mesmo procedimento, mas substituindo o ácido por NaOH, totalizando assim 1,0 L de solução.
- O estudante deveria observar a cor da solução ao final do experimento.
A professora mostrou a tabela com alguns valores de pH resultantes conforme os números tirados nos dados. Ela pediu, então, aos estudantes que utilizassem seus conhecimentos e a tabela para prever em quais combinações de dados a cor final do indicador seria vermelha.
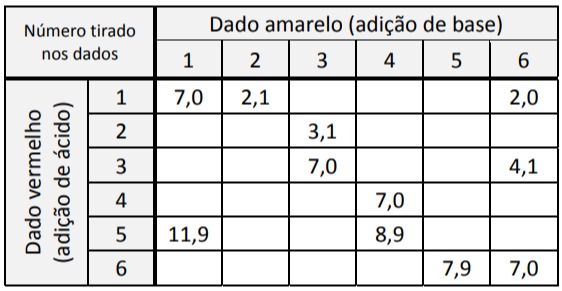
A probabilidade de, após realizar o procedimento descrito, a solução final preparada por um estudante ser vermelha é de:
- A) 1/12
- B) 1/6
- C) 1/4
- D) 11/36
- D)
- E) 5/12
A alternativa correta é letra C)
1) Como para o indicador ser vermelho, é necessário que o pH seja menor que 3 (ácido), podemos excluir das possibilidades todos os que possuem caráter neutro ou básico. Para ficar mais claro visualmente coloquei os básicos em azul e os neutros em amarelo.
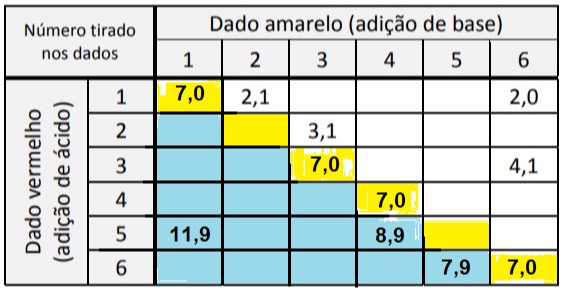
Perceba que eles serão neutros quando a concentração adicionada de ácido e base forem iguais e eles serão básicos quando a adição de base for superior a adição de ácido.
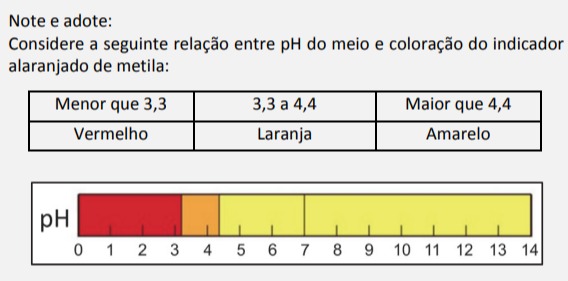
2) Perceba que como pH = - log [H+], temos que a concentração do pH na linha da tabela não irá mudar muito. Com isso, podemos concluir que o pH será menor que 3,3 para as seguintes possibilidades (grifadas de vermelho):
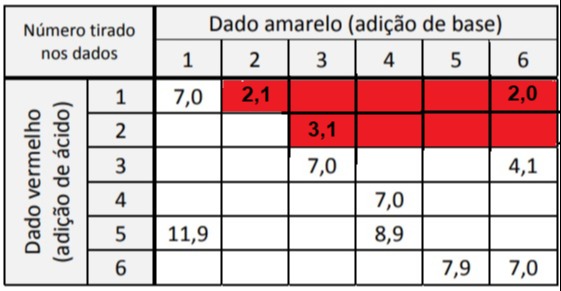
3) Com isso, a probabilidade de que a combinações de dados dê a cor final do indicador como vermelha é
Questão 2
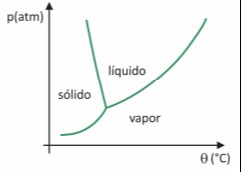
Apesar de ser um processo que requer, industrialmente, uso de certa tecnologia, existem evidências de que os povos pré‐ colombianos que viviam nas regiões mais altas dos Andes conseguiam liofilizar alimentos, possibilitando estocá‐los por mais tempo. Assinale a alternativa que explica como ocorria o processo de liofilização natural:
- A) A sublimação da água ocorria devido às baixas temperaturas e à alta pressão atmosférica nas montanhas.
- B) Os alimentos, após congelados naturalmente nos períodos frios, eram levados para a parte mais baixa das montanhas, onde a pressão atmosférica era menor, o que possibilitava a sublimação.
- C) Os alimentos eram expostos ao sol para aumentar a temperatura, e a baixa pressão atmosférica local favorecia a solidificação.
- D) As temperaturas eram baixas o suficiente nos períodos frios para congelar os alimentos, e a baixa pressão atmosférica nas altas montanhas possibilitava a sublimação.
- E) Os alimentos, após congelados naturalmente, eram prensados para aumentar a pressão, de forma que a sublimação ocorresse.
A alternativa correta é letra D)
A sublimação ocorre pela passagem direto do estado sólido para o estado de vapor. Pelo gráfico pode-se observar que esta possibilidade só existe para valores baixos de pressão. Como em altas altitudes a pressão atmosférica é menor e as temperaturas também o são existem as condições necessárias para que a água congele e sublime espontaneamente,
Alternativa D.
Questão 3
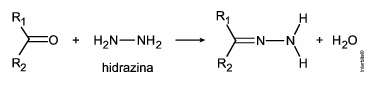
pode ser explorada para a quantificação de compostos cetônicos gerados, por exemplo, pela respiração humana. Para tanto, uma hidrazina específica, a 2,4‐dinitrofenilhidrazina, é utilizada como reagente, gerando um produto que possui cor intensa.
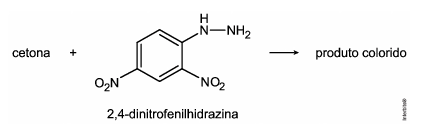
Considere que a 2,4‐dinitrofenilhidrazina seja utilizada para quantificar o seguinte composto:
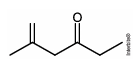
Nesse caso, a estrutura do composto colorido formado será:
- A)

- B)
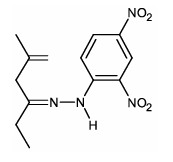
- C)
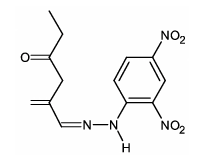
- D)
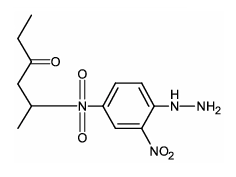
- E)
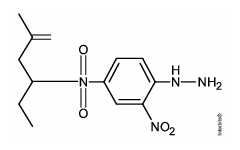
A alternativa correta é letra B)
Pela equação mostrada deve-se chegar em um produto em que a dupla ligação com o oxigênio foi substituída por uma dupla ligação com um N enquanto o resto da cadeia deve permanecer inalterado. A única alternativa que representa isto é a alternativa B.
Questão 4
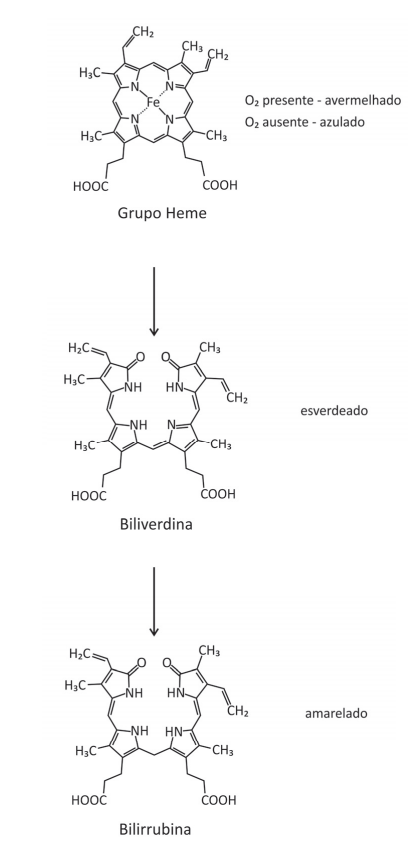
Com base nas informações e nas representações, é correto afirmar:
- A) A conversão da biliverdina em bilirrubina ocorre por meio de uma redução.
- B) A biliverdina, assim como a hemoglobina, é capaz de transportar O2 para as células do corpo, pois há oxigênio ligado na molécula.
- C) As três estruturas apresentadas contêm o grupo funcional amida.
- D) A degradação do grupo heme para a formação da biliverdina produz duas cetonas.
- E) O grupo heme, a biliverdina e a bilirrubina são isômeros.
A alternativa correta é letra A)
(A) VERDADEIRO. Há a adição de átomos de hidrogênio em uma dupla ligação entre carbonos e um átomo de nitrogênio o que faz com ocorra uma redução.
(B) FALSO. É necessário o átomo de Fe para que ocorra este transporte.
(C) FALSO. O grupo heme não possui a função amida.
(D) FALSO. A degradação produz grupos amidas.
(E) FALSO. Não possuem a mesma fórmula estrutural.
5) Os movimentos das moléculas antes e depois de uma reação química obedecem aos princípios físicos de colisões. Para tanto, cada átomo é representado como um corpo pontual com uma certa massa, ocupando uma posição no espaço e com uma determinada velocidade (representada na forma vetorial). Costumeiramente, os corpos pontuais são representados como esferas com diâmetros proporcionais à massa atômica. As colisões ocorrem conservando a quantidade de movimento. Considerando um referencial no qual as moléculas neutras encontram‐se paradas antes e após a colisão, a alternativa que melhor representa o arranjo de íons e moléculas instantes antes e instantes depois de uma colisão que leva à reação
- A)

- B)

- C)

- D)

- E)
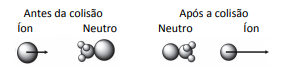
A alternativa correta é letra C)
A reação ocorrerá com o choque do íon F- na molécula neutra formando o CH3F e a ejeção do íon Cl-. O íon F- é menor que o íon Cl- e por isto terá que possuir um vetor velocidade maior para que haja a conservação do momento linear.
Lembrando que momento linear é .
Questão 6
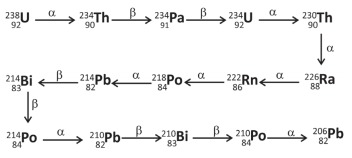
Com base nessas informações e em seus conhecimentos, é correto afirmar:
- A) O decaimento de um átomo de 238U produz, ao final da série de decaimento, apenas um átomo de He
- B) O decaimento do 238U para 234U gera a mesma quantidade de He que o decaimento do 234U para 230Th.
- C) Daqui a 4,5 bilhões de anos, a quantidade de He no planeta Terra será o dobro da atual.
- D) O decaimento do 238U para 234U gera a mesma quantidade de He que o decaimento do 214Pb para 214Po.
- E) A produção de He ocorre pela sequência de decaimento a partir do 206Pb.
A alternativa correta é letra B)
(A) FALSO. Haverá a formaão de 8 átomos de He que é o mesmo que o número de partículas alfa emitidas.
(B) VERDADEIRO. Cada um destes decaimentos produz apenas uma partícula alfa que é exatamente o núcleo de 4He que irá capturar elétrons e se transformar em uma espécie neutra.
(C) FALSO. O decaimento de todo o U não seria o único responsável pela produção de He no planeta o que não nos permite afirmar isto.
(D) FALSO. O decaimento do 214Pb não gera nenhuma partícula alfa.
(E) FALSO. Começa a partir do 238U.
Questão 7
Esse comportamento pode ser descrito pela equação (I), que relaciona o valor de pH com o logaritmo da concentração do metal (log []), para uma dada temperatura, em que
é a constante do produto de solubilidade do hidróxido do metal.
Equação (I): log[] = log (
) +14n – n (pH)
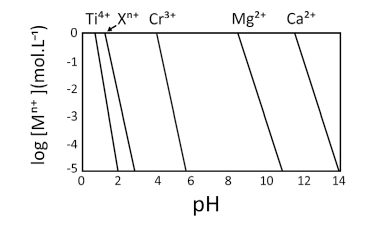
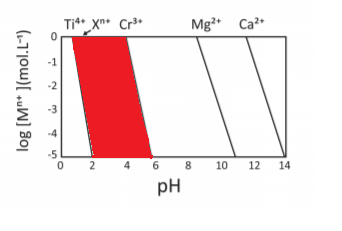
O comportamento da equação (I) é representado no gráfico, no qual as linhas mostram o valor de pH e log [] em que se inicia a precipitação de cada um dos metais. Em condições mais alcalinas do que a apresentada na linha de cada metal, será observada a espécie insolúvel como hidróxido e, em condições mais ácidas do que a apresentada na linha, será observada a espécie em sua forma solúvel.
a) Pinte, no gráfico da folha de respostas, a região onde o se encontra na forma solúvel e o
se encontra na forma de
insolúvel.
b) As linhas que representam e
possuem a mesma inclinação, mas diferem da inclinação daslinhas que representam
e
, que possuem a mesma inclinação entre si. Indique a carga n de
e justifique com base na equação (I).
c) Indique qual das espécies tem maior valor de :
ou
. Justifique com base nas informações dadas
a)
b)
Analisando a equação 1:
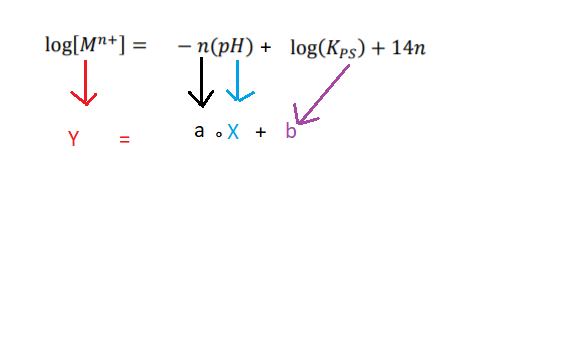
A inclinação da reta (a) é n ( carga do metal) , logo metais que possuem a mesma carga possuem a mesma inclinação, por iso a carga de X é +3.
c)´´b´´ está relacionada com o kps, onde eixo X corta a reta, então a reta maior b possuí o composto com maior Kps no caso o hidróxido de cálcio.
Questão 8
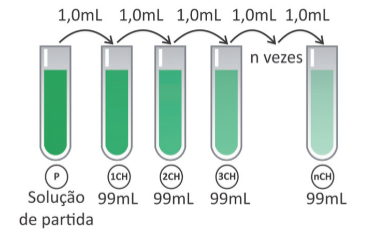
Considerando uma solução de partida de 100 mL com concentração 1 mol/L de princípio ativo, a partir de qual diluição centesimal a solução passa a não ter, em média, nem mesmo uma molécula do princípio ativo?
- A) 12ª diluição (12CH).
- B) 24ª diluição (24CH).
- C) 51ª diluição (51CH).
- D) 99ª diluição (99CH).
- E) 200ª diluição (200CH).
A alternativa correta é letra A)
A cada diluição o número de moléculas do princípio ativo seria diminuído em 100 vezes, já que o processo trata-se de uma diluição centesimal.
A concentração é a razão entre a quantidade de matéria (em mol) e o volume:
A quantidade de matéria pode ser calculada pela multiplicação da concentração pelo volume:
O número de Avogadro relaciona a quantidade de partículas em 1mol de quantidade de matéria. Portanto, a solução de partida teria um número de moléculas iguais a:
Para saber o número de moléculas após cada diluição deve-se dividir o número de moléculas iniciais por 100 elevado ao número de diluições.
Se n = 11, ainda restariam 6 moléculas nesta diluiçã. Portanto n = 12 seria o número de diluições em que não haveria mais nenhuma molécula deste princípio ativo.
Questão 9
a) Escreva a fórmula de Lewis da ureia.
b) Calcule quantos litros de solução de Arla 32 são necessários para consumir todo o NO2 produzido em uma viagem de 100 km, considerando que a quantidade de NO2 formado por esse veículo é de 460 mg por km rodado. Indique os cálculos.
c) Considerando que a reação entre NH3 e NO forma os mesmos produtos que a reação II, o volume gasto de Arla 32 para consumir o NO seria menor, igual ou maior ao usado para consumir uma mesma quantidade em mol de NO2? Justifique mostrando a reação entre NH3 e NO.
Note e adote:
Considerar todas as reações com 100% de rendimento.
Massas molares: ureia = 60 g.mol-1 ; NO2 = 46 g.mol-1
Distribuição eletrônica: H: 1s1 ; C: 1s2 2s2 2p2 ; N: 1s2 2s2 2p3 ; O: 1s2 2s2 2p4
a)

b) Primeiro, calculamos a quantidade de dióxido de nitrogênio produzido na viagem:
Pela massa molar, percebemos que 46g de NO2 correspondem a 1 mol dessa substância.
Analisando a proporção molar de NO2 para NH3 temos:
8 NH3 __________ 6 NO2
x __________ 1 NO2
Analisando a proporção molar de NH3 e uréia, temos:
1 uréia __________ 2 NH3
x __________ 4/3 NH3
Transformando isso em massa usando a massa molar:
Pela concentração da solução de Arla 32, temos:
32g _________ 100 mL
40g _________ x
c) Pela reação balanceada entre NH3 e NO, temos:
Vemos que o volume gasto de Arla 32 seria menor para consumir no NO.
Ao analisarmos os coeficientes, vemos que, para consumir 6 mols de NO, são necessários 4 mols de NH3. No caso do NO2, precisaríamos de 8 mols de NH3 (pela equação (II) do enunciado. Logo, como NH3 é produzido através da uréia, será necessária menor quantidade de Arla 32 para consumir o NO.
Questão 10
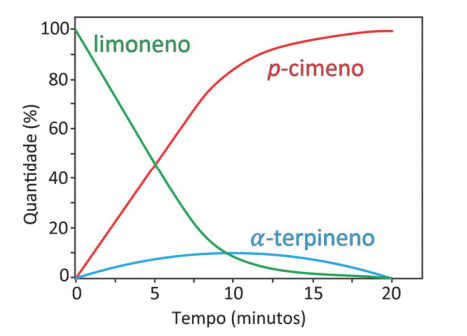
Uma representação adequada para esse processo é:
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra E)
Inicialmente devemos separar os reagentes dos produtos, as substâncias que estão sendo consumidas são os reagentes as que estão sendo produzidas são produtos e as concentrações que não se alteram no decorrer da reação são catalisadores, assim temos:
Reagentes: limoneno e α‐terpineno
Produtos: α‐terpineno e p‐cimeno
Perceba que uma substância aparece nos reagentes e protudos o ߙ‐terpineno. Isso ocorre porque em um momento sua concentração aumenta (sendo produzido) e outro momento sua concentração diminuiu (reagindo). Como o ߙ‐terpineno tem sua concentração zerado ao final da reação não se trata de um equilíbrio químico em que todas as espécies devem existir.
Dessa forma a única alternativa possível é a letra E.
