Prova de Química da Fuvest 2020 Resolvida
Questão 11
(I) (s) +
+ (aq) +
→
(s) E° = + 1,00 V
(II) (aq) +
(s) +
→
(s) E° = ‐ 2,84 V
(III) (aq) +
→
(s) E°= ‐ 3,04 V
Considerando essas semirreações:
a) Escreva a reação global da bateria que utiliza o lítio metálico como um dos eletrodos.
b) Indique qual dos dois materiais, lítio metálico ou lítio metálico intercalado em grafita, será um agente redutor mais forte. Justifique com os valores de potencial de redução padrão.
Em 1800, José Bonifácio descobriu o mineral petalita, de fórmula (na qual X é um metal alcalino). Em 1817, ao assumir que X =
, o químico sueco Johan Arfwedson observou que a petalita apresentaria uma porcentagem de metal alcalino superior ao determinado experimentalmente. Ao não encontrar outros substitutos conhecidos que explicassem essa incongruência, ele percebeu que estava diante de um novo elemento químico, o Lítio (
).
c) Explique, mostrando os cálculos, como a observação feita por Arfwedson permitiu descobrir que o elemento novo era o Lítio. Note e adote: Massas molares ():
Li = 7; O = 16; Na = 23; Al = 27; Si = 28.
% em massa de Al na petalita: 8,8%.
a)
Somando as semirreações:
b)
O agente redutor mais forte é o que possui maior potencial de redução. Logo, é o lítio metálico:
c)
Al = 27 g/mol
Si4 = 4*28 g/mol
O10 = 10x16 g/mol
A porcentagem de alumínio é 8,8% ou 0,088. Logo:
que é aproximadamente a massa molar do lítio.
Questão 12

Considerando as informações apresentadas no texto e no quadro, a principal razão para a diferença de coloração descrita é que a fração oleosa

- A) fica mais quente do que a aquosa, degradando a betanina; o mesmo não é observado com o licopeno, devido à sua cadeia carbônica longa.
- B) está mais exposta ao ar, que oxida a betanina; o mesmo não é observado com o licopeno, devido à grande quantidade de duplas ligações.
- C) é apolar e a betanina, polar, havendo pouca interação; o mesmo não é observado com o licopeno, que é apolar e irá interagir com o azeite
- D) apolar e a aquosa, polar, mantendo‐se separadas; o licopeno age como um surfactante misturando as fases, colorindo a oleosa, enquanto a betanina não.
- E) tem alta viscosidade, facilitando a difusão do licopeno, composto de menor massa molar; o mesmo não é observado para a betanina, com maior massa.
A alternativa correta é letra C)
(A) FALSO. Não há degradação de nenhum composto.
(B) FALSO. Não há oxidação dos compostos.
(C) VERDADEIRO. O que ocorre é só uma dissolução preferencial dos compostos em cada uma das fases.
(D) FALSO. O licopeno não age como surfactante como pode ser visto que as fases se mantiveram separadas.
(E) FALSO. A diferença de polaridade que promove esta separação e não a viscosidade.
13) O médico Hans Krebs e o químico Feodor Lynen foram laureados com o Prêmio Nobel de Fisiologia e Medicina em 1953 e 1964, respectivamente, por suas contribuições ao esclarecimento do mecanismo do catabolismo de açúcares e lipídios, que foi essencial à compreensão da obesidade. Ambos lançaram mão de reações clássicas da Química Orgânica, representadas de forma simplificada pelo esquema que mostra a conversão de uma cadeia saturada em uma cetona, em que cada etapa é catalisada por uma enzima (E) específica:
a) A oxidação de um álcool secundário leva a formação de uma cetona como representado abaixo:

b) Para possuir isômeria geométrica cis-trans é necessário que o compostos possua uma dupla ligação, como o composto II:
c) O aumento da cadeia carbônica dificulta a solubilização do composto pela água, no caso dos compostos I e II a solubilização é muito difícil e independe do tamanho da cadeia carbônica, pois são hidrocarbonetos apolares, já o álcool faz ligação de hidrogênio com água e pode ser solúvel no caso de um composto pequeno.
14) Pesquisadores(…) conseguiram controlar reações químicas de um modo inovador. Usaram feixes de laser para promover um esbarrão entre dois átomos e uni‐los, criando uma molécula. Utilizando pinças ópticas (feixes de laser altamente focados capazes de aprisionar objetos microscópicos), os pesquisadores empurraram um átomo do elemento químico césio (Cs) contra um átomo de sódio (Na) até que colidissem. Um terceiro laser foi lançado sobre ambos, fornecendo energia extra para criar a molécula NaCs. Na natureza, as moléculas formam‐se a partir da interação de átomos por acaso. Por suas características químicas, césio e sódio jamais originariam uma molécula espontaneamente. (…)
- A) o Cs é um elemento químico radioativo e, devido a essa característica química, a molécula de NaCs não se formaria sem esse modo inovador (L.2), que estabiliza o decaimento
- B) o raio atômico do Na é maior que o do Cs, portanto, a sua energia de ionização também é maior. O esbarrão (L.3) entre os átomos retira um elétron do Na, permitindo a ligação.
- C) o terceiro laser (L.8) usado no experimento serviu para retirar um nêutron do Cs, tornando‐o um cátion e possibilitando a reação com o Na.
- D) na natureza, com esses elementos se esbarrando por acaso (L.10‐11), a tendência seria formar CsNa, e não NaCs, justificando o caráter inovador do experimento.
- E) o Cs e o Na não formariam uma molécula espontaneamente (L.11‐12), uma vez que ambos têm grande tendência a formarem cátions e ligações iônicas.
A alternativa correta é letra E)
A)INCORRETA- Justificativa incorreta, esse método não estabiliza o decaimento do césio
B) INCORRETA- O raio atômico do Na é menor que o raio atõmico do Cs, além disso esse fator não explica a não espontaneidade do composto.
C) INCORRETA- Justificativa incorreta, o feixe serviu para aproximar os átomos.
D)INCORRETA- Na natureza caso esses elementos se esbarrassem por acaso nada aconteceria
E) CORRETA Cs e Na são metais alcalinos que possuem uma baixíssima eletronegatividade e uma alta tendência a perder elétrons. Por isto, a ligação entre estes dois átomos seria tão difícil de ocorrer.
Questão 15

Em um laboratório, o mesmo experimento foi realizado em dois frascos. Em ambos, 100 mL de solução 0,1 de
e 100 mL de solução 0,2
de
foram misturados. Ao primeiro frasco foi também adicionado 20 mL de água destilada, enquanto ao segundo frasco foi adicionado 20 mL de solução 0,1
de iodeto de sódio (
).
A tabela a seguir apresenta os dados de solubilidade dos produtos da reação em diferentes temperaturas.

Responda aos itens a seguir considerando os dados do enunciado e o equilíbrio químico de solubilidade do iodeto de chumbo:
(s) ⇌
(aq) +
(aq)
a) Indique se o procedimento do segundo frasco favorece ou inibe a formação de mais sólido amarelo.
b) Para separar o precipitado da solução do primeiro frasco e obter o sólido e seco, foi recomendado que, após a precipitação, fosse realizada uma filtração em funil com papel de filtro, seguida de lavagem do precipitado com água para se retirar o
formado e, na sequência, esse precipitado fosse colocado para secar. Nesse caso, para se obter a maior quantidade do
, é mais recomendado o uso de água fria (4 °C) ou quente (80 °C)? Justifique.
c) Encontre a constante do produto de solubilidade () do iodeto de chumbo a 32 °C.
- O procedimento feito no segundo frasco favorece a formação do sólido amarelo,pois a solução de iodeto de sódio fornece íons I- ao meio:
NaI(aq)→Na+(aq) + I-(aq)
Esses íons deslocam o equilíbrio químico no sentido de formação do sólido PbI2(s).
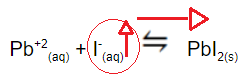
- Com o objetivo de aumentar o rendimento do processo para obter a maior quantidade de precipitado possível deve-se utilizar a água fria a 4ºC já que a solubilidade é menor como indicado na tabela, visando reduzir a perda de precipitado por solubilização durante a lavagem.
- Inicialmente vamos calcular a relação da solubilidade S com o Kps do iodeto de chumbo.
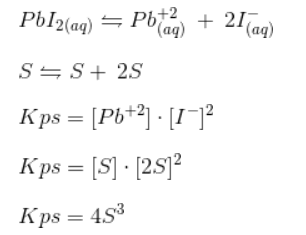
S é a solubilidade em mol/L , usando a fórmula n=m/mm , podemos transformar a concentração de g/L para mol/L:


Questão 16
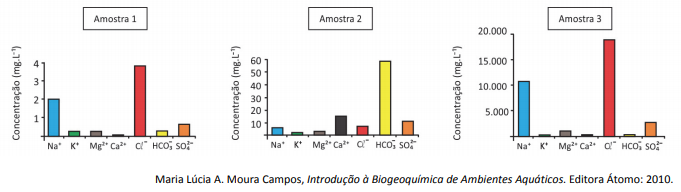
a) O bicarbonato na água pode vir de diferentes fontes. Cite uma fonte de bicarbonato comum às três amostras.
b) Preencha a tabela da folha de respostas com a correspondência entre as amostras 1, 2 e 3 e o ambiente em que foram coletadas.
É esperado que a concentração de íons cloreto na água coletada da chuva em um ambiente continental seja igual, maior ou menor à de ambientes costeiros (ambos sem poluição)? Justifique sua resposta.
a) O bicarbonato pode vir do equilíbrio do ácido carbônico em água, que por sua vez vem da solubilização do gás carbônico atmosférico em água.
Pela equação:
b)
| Ambiente | Água do mar | Água de chuva em região costeira | Água doce de rio |
| Amostra | 3 | 1 | 2 |
Espera-se que a concentração de íons cloreto na água de chuva de um ambiente continental seja igual à de ambientes costeiros. Isso ocorre porque no processo de evaporação, a água muda de estado físico, mas os íons não voláteis não. Portanto, não importa a concentração inicial de íons em água líquida, pois na evaporação os íons permanecem em solução.
Questão 17

Disponível em https://www.boredpanda.com/.
O café quente é então adicionado na xícara e, passado um tempo, gotículas começam a pingar sobre a bebida, simulando uma chuva doce e reconfortante. A adição de café quente inicia o processo descrito, pois

- A) a temperatura do café é suficiente para liquefazer a sacarose do algodão‐doce, fazendo com que este goteje na forma de sacarose líquida.
- B) o vapor de água que sai do café quente irá condensar na superfície do algodão‐doce, gotejando na forma de água pura.
- C) a sacarose que evapora do café quente condensa na superfície do algodão‐doce e goteja na forma de uma solução de sacarose em água
- D) o vapor de água encontra o algodão‐doce e solubiliza a sacarose, que goteja na forma de uma solução de sacarose em água.
- E) o vapor de água encontra o algodão‐doce e vaporiza a sacarose, que goteja na forma de uma solução de sacarose em água.
A alternativa correta é letra D)
A) INCORRETO- Temperatura de fusão da sacarose é 186°C, como o café está a 100°C não capaz de fundir ( derreter) a sacarose
B) INCORRETO- Quando o vapor de água condensa na superfície do algodão doce ocorre a solubilização da glicose e a água precipita como uma solução ( mistura homogênea) de glicose e água.
C)INCORRETO- A sacarose está no algodão-doce, no estado sólido e não no café.
D) CORRETO-O que evapora do café a água que estará à uma temperatura próxima de 100ºC, inferior a temperatura de fusão da sacarose. O que acontece é que a água vaporizada irá condensar no algodão doce e será formada uma solução de açúcar, veja que a solubilidade é alta, que irá precipitar na xícara de café.
E) INCORRETO-A temperatura do café não é suficiente para vaporizar a glicose.
