Prova de Química do ENEM 2016 Resolvida
Questão 11
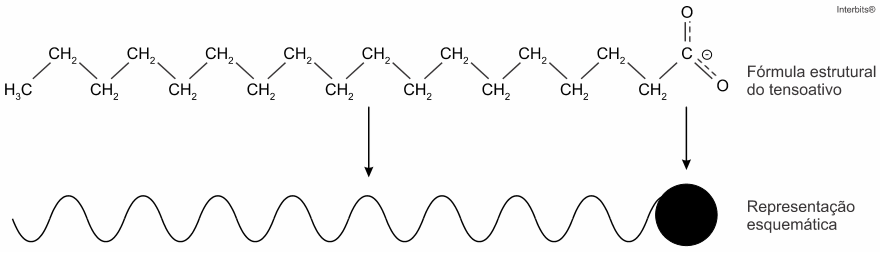
Ao adicionar um tensoativo sobre a água, suas moléculas formam um arranjo ordenado.
Esse arranjo é representado esquematicamente por:
- A)

- B)

- C)

- D)

- E)

A alternativa correta é letra C)
A parte escura do tensoativo("A cabeça") como podemos ver na fórmula estrutural é a parte polar, enquanto a a cadeia carbônica("Cauda") é a parte apolar.
A parte da cabeça, por ser polar tende a se aproximar mais da água que também é polar. E a calda tende a ficar para cima por ser apolar.
Essa organização é apresentada esquematicamente na letra C.
Questão 12

Em relação ao coeficiente de partição da testosterona, as lipofilias dos compostos 1 e 2 são, respectivamente, a
- A) menor e menor que a lipofilia da testosterona.
- B) menor e maior que a lipofilia da testosterona.
- C) maior e menor que a lipofilia da testosterona.
- D) maior e maior que a lipofilia da testosterona.
- E) menor e igual à lipofilia da testosterona.
A alternativa correta é letra D)
A lipofilia mede o grau de afinidade que a susbtância tem com ambientes apolares; pode ser avaliada pelo coeficiente de partição (quanto mais apolar a substância, maior seu coef. de partição).
molécula de testosterona: grupo X é uma hidroxila (OH) — polar.
compostos 1 e 2: grupo X corresponde, respectivamente, a H e CH3 — apolares.
As lipofilias dos compostos 1 e 2 são maiores do que a lipofilia da testosterona.
Alternativa D.
Questão 13
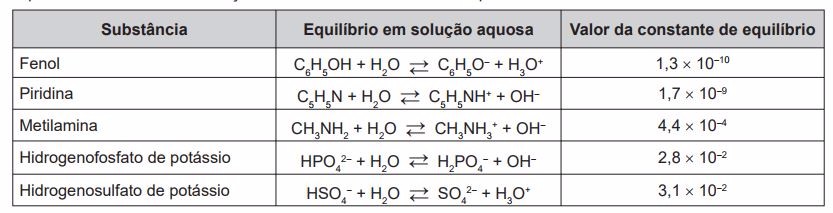
Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
- A) fenol.
- B) piridina.
- C) metilamina.
- D) hidrogenofosfato de potássio.
- E) hidrogenosulfato de potássio.
A alternativa correta é letra D)
Na borracha vulcanizada, há o elemento enxofre (S) unindo a estrutura das fibras de polímero. Quando ela é queimada, ocorre a combustão desse elemento, produzindo o gás poluente SO2 que, na presença da água da chuva, forma a "chuva ácida", que contém ácido sulfúrico (H2SO4).
Esse gás, que é um óxido ácido, para ser removido, deve ser borbulhado em uma solução básica (com íons OH—) para ser neutralizado. Quanto maior for a constante de ionização da base, maior será o caráter básico da solução e, assim, mais eficiente na remoção de SO2.
Dentre as substâncias básicas citadas (II, III e IV), o hidrogenofosfato de potássio (IV) apresenta o maior valor da constante de equilíbro (2,8 . 10-2).
Alternativa D.
14) Nucleófilos (Nu-) são bases de Lewis que reagem com haletos de alquila, por meio de uma reação chamada substituição nucleofílica (SN), como mostrado no esquema:
- A) éter.
- B) éster.
- C) álcool.
- D) haleto.
- E) hidrocarboneto.
A alternativa correta é letra A)
Nucleófilos (Nu–) reagem com haletos de alquila através de uma reação denominada substituição nucleofílica (SN). Observe o esquema:
A reação entre metóxido de sódio (Nu–= CH3O–) e brometo de metile ocorre de acordo com a equação:
A função do produto orgânico gerado é éter.
Alternativa A.
Questão 15

Qual processo de separação é responsável pela aromatização promovida?
- A) Filtração simples.
- B) Destilação simples.
- C) Extração por arraste.
- D) Sublimação fracionada.
- E) Decantação sólido-líquido.
A alternativa correta é letra C)
Durante o processo de aromatização da sauna, o gerador de vapor joga um jato de vapor d'água quente responsável pela extração das moléculas orgânicas que dão cheiros às ervas.
Neste processo, é claro que a temperatura elevada facilita a extração. Mas, o principal mecanismo de extração se dá por um processo físico de colisão.
Isso mesmo! O jato de vapor quente bate nas folhas das ervas e a energia dessa colisão é responsável pela extração das moléculas orgânicas. E, por isso, dizemos que essas moléculas orgânicas são literalmente arrastadas.
Por esse motivo, tal processo recebe o nome de Extração por Arraste.
Gabarito Correto: C.
16) Pesquisadores recuperaram DNA de ossos de mamute (Mammuthus primigenius) encontrados na Sibéria, que tiveram sua idade de cerca de 28 mil anos confirmada pela técnica do carbono 14.
- A) proporção conhecida entre carbono 14 e carbono 12 na atmosfera ao longo dos anos.
- B) decomposição de todo o carbono 12 presente no organismo após a morte.
- C) fixação maior do carbono 14 nos tecidos de organismos após a morte.
- D) emissão de carbono 12 pelos tecidos de organismos após a morte.
- E) transformação do carbono 12 em carbono 14 ao longo dos anos.
A alternativa correta é letra A)
Como um fóssil não continua a absorver carbono, o número de C-14 que ele possui vai diminuindo com o tempo por conta do decaimento radioativo deste isótopo. Se conhecermos a proporção entre C-14 e C-12 na atmosfera, podemos estipular uma data para o fóssil analisado.
Alternativa A.
17) Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
- A) 1.
- B) 29.
- C) 60.
- D) 170.
- E) 1 000.
A alternativa correta é letra B)
O texto da questão nos diz que:
- "Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça";
- A vinhaça gerada para a irrigação da plantação tem um um teor médio de 60 mg/L de fósforo.
Com essas duas informações precisamos encontrar a relação entre o volume de etanol produzido e a quantidade de fósforo presente na vinhaça. Usando (2):
O que quer dizer que a cada litro de etanol produzido, são gerados 1080mg de fósforo, agora basta sabermos a quantidade de fósforo quando forem produzidos 27000L de Etanol. Substituindo em (1) a informação, obtida anteriormente, da proporção de fósforo em 18L de vinhaça:
Descobrimos assim que a quantidade total de fósforo disponível na vinhaça é de 29,16kg, que está próximo de 29 kg.
Resposta: B
18) Primeiro, em relação àquilo a que chamamos água, quando congela, parece-nos estar a olhar para algo que se tornou pedra ou terra, mas quando derrete e se dispersa, esta torna-se bafo e ar; o ar, quando é queimado, torna-se fogo; e, inversamente, o fogo, quando se contrai e se extingue, regressa à forma do ar; o ar, novamente concentrado e contraído, torna-se nuvem e nevoeiro, mas, a partir destes estados, se for ainda mais comprimido, torna-se água corrente, e de água torna-se novamente terra e pedras; e deste modo, como nos parece, dão geração uns aos outros de forma cíclica.
- A) troca de átomos entre as diferentes moléculas do material.
- B) transmutação nuclear dos elementos químicos do material.
- C) redistribuição de prótons entre os diferentes átomos do material.
- D) mudança na estrutura espacial formada pelos diferentes constituintes do material.
- E) alteração nas proporções dos diferentes isótopos de cada elemento presente no material.
A alternativa correta é letra D)
a) Falsa. A troca de átomos entre as moléculas não altera o estado físico do material
b) Falsa. A transmutação nuclear altera o número de elétrons, prótons ou neutrons do material
c) Falsa. Os prótons não são distribuídos de maneira alguma, exceto por transmutação nuclear (item b)
d) Verdadeira. As moléculas diminuem os espaços entre si de maneira a alterar o estado físico do material
e) Falsa. O elemento pode sofrer alteração de estado físico mesmo sem possuir isótopos no material
Alternativa D
19) O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
- A) Ligações dissulfeto.
- B) Ligações covalentes.
- C) Ligações de hidrogênio.
- D) Interações dipolo induzido-dipolo induzido.
- E) Interações dipolo permanente-dipolo permanente.
A alternativa correta é letra D)
Ambas as substâncias, benzeno (C6H6) e carvão (C), são apolares. Ocorre, entre o adsorvente e a substância adsorvida, a formação de interações dipolo induzido — dipolo induzido (forças de London, um tipo de força de van der Waals).
Alternativa D.
Questão 20

Em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH  CH3OH + NaBr
CH3OH + NaBr
As massas molares (em g mol) desses alimentos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é mais próximo de a
- 22%.40%.50%.67%.75%.
A alternativa correta é letra D)
► Reação química balanceada
CH3Br + NaOH → CH3OH + NaBr
► Proporção em massa da reação
As massas molares são: CH3Br = 95g/mol ; NaOH = 40g/mol ; CH3OH = 32g/mol ; NaBr = 103g/mol. Então a proporção em massa da reação é:
95g de CH3Br : 40 g de NaOH : 32g de CH3OH : 103g de NaBr.
► Identificação do reagente em excesso
A questão informa que foram adicionados 80g de NaOH e 142,5g de CH3Br, então é preciso calcular - segundo a proporção - quanto reage de cada um dos reagente. A proporção informa que 40g de NaOH reagem com 95g de CH3Br, então a massa que reage com 80g de NaOH é:
95g de CH3Br ---- 40g de NaOH
x ---------------------- 80g de NaOH
x = 190g de CH3Br
Como na reação foram adicionados apenas 142,5g de CH3Br, significa que ele está limitando a reação e o NaOH está em excesso.
► Massa obtida considerando 100% de rendimento
Todos os cálculos devem ser feitos com o reagente limitante, então é necessário calcular a massa obtida de CH3OH a partir de 142,5g de CH3Br. Para fazer esse cálculo, utilizamos a proporção estequiométrica:
95g de CH3Br ---------- 32g de CH3OH
142,5g de CH3Br ------ y
y = 48g de CH3OH
► Rendimento
Com 100% de rendimento, deveria ser obtido 48g de CH3OH, então o rendimento que equivale a 32g é:
48g de CH3OH ------- 100%
32g de CH3OH -------- R
R = 66,7%
