Prova de Química do ENEM 2017 Resolvida
Questão 1

Considere a ozonólise do composto 1-fenil-2-metilprop-1-eno:

Quais são os produtos formados nessa reação?
- A) Benzaldeído e propanona
- B) Propanal e benzaldeído
- C) 2-fenil-etanal e metanal
- D) Benzeno e propanona
- E) Benzaldeído e etanal
A alternativa correta é letra A)
Segundo a equação, a ozonólise do composto 1-fenil-2-metilprop-1-eno resulta em benzaldeído e propanona.
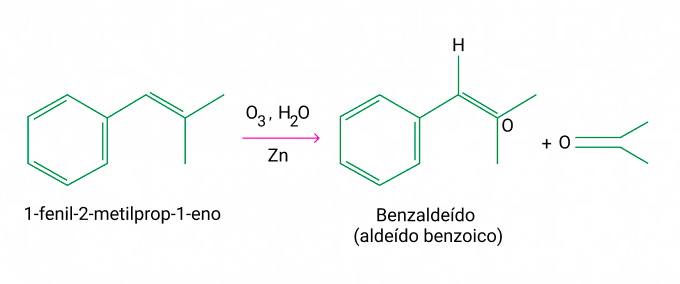
Alternativa A.
Questão 2
Uma mistura de hexano com 5% (v/v) de acetona foi utilizada como fase móvel na separação dos componentes de um extrato vegetal obtido a partir de pimentões. Considere que esse extrato contém as substâncias representadas.
RIBEIRO, N. M.; NUNES, C. R. Análise de pigmentos de pimentões por cromatografia em papel. Química Nova na Escola, n. 29, ago. 2008 (adaptado).

A substância presente na mistura que migra mais lentamente é o(a)
- A) licopeno.
- B)
- caroteno.
- C)
- D) capsorubina.
- E)
- criptoxantina.
A alternativa correta é letra D)
Do enunciado da questão temos as seguintes informações:
"Os componentes capazes de formar interações intermoleculares mais fortes com a fase estacionária migram mais lentamente."
"É a água absorvida que funciona como fase estacionária líquida e que interage com a fase móvel..."
Concluímos então que o composto que migrará mais lentamente deve ser aquele com maior afinidade com a fase estacionária, ou seja, com a água.
Dos compostos apresentados, o que possui mais hidroxilas e oxigênios com pares de elétrons livres (capazes de formar pontes de hidrogênio com a água) é a capsorubina, portanto essa substância que terá maior afinidade com a água e consequentemente será que que migrará mais lentamente.
GABARITO: d
3) No ar que respiramos existem os chamados “gases inertes”. Trazem curiosos nomes gregos, que significam “o Novo”, “o Oculto”, “o Inativo”. E de fato são de tal modo inertes, tão satisfeitos em sua condição, que não interferem em nenhuma reação química, não se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante séculos: só em 1962 um químico, depois de longos e engenhosos esforços, conseguiu forçar “o Estrangeiro” (o xenônio) a combinar-se fugazmente com o flúor ávido e vivaz, e a façanha pareceu tão extraordinária que lhe foi conferido o Prêmio Nobel.
- A) Densidade
- B) Condutância
- C) Eletronegatividade
- D) Estabilidade nuclear
- E) Temperatura de ebulição
A alternativa correta é letra C)
Apesar de o Xenônio ser um gás nobre e resistir à alteração da sua distribuição eletrônica, o flúor é capaz de deslocar seus elétrons e formar uma ligação, devido ao seu alto poder de atração de elétrons, ou seja, sua alta eletronegatividade.
Gabarito C
A | não são características que justificam sua escolha. |
B | não são características que justificam sua escolha. |
C | O flúor é o elemento mais eletronegativo da tabela periódica. |
D | não são características que justificam sua escolha. |
E | não são características que justificam sua escolha. |
Questão 4

Considere as seguintes equações termoquímicas:

O valor mais próximo de ΔrH0 em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
- A) -14
- B) -17
- C) -50
- D) -64
- E) -100
A alternativa correta é letra B)
O calor de reação para a equação do FeO com o CO pode ser determinado pela Lei de Hess através das reações fornecidas, que seriam as etapas de uma equação global, da seguinte forma:
Reação 1: Fe2O3 + 3 CO → 2 Fe + 3 CO2
Reação 2: 3 FeO + CO2 → Fe3O4 + CO
Reação 3: 2 Fe3O4 + CO2 → 3 Fe2O3 + CO
————————————————————-
Equação global: FeO + CO → Fe + CO2
A reação 1 é dividida por 2 para equilibrar o Fe com a equação global;
A reação 2 é dividida por 3 para equilibrar o FeO com a equação global;
A reação 3 é dividida por 6 para que o Fe3O4 e o Fe2O3 sejam “cortados” pois não aparecem na equação global. Assim, o CO e o CO2 ficarão ajustados como na equação global.
As mesmas operações são aplicadas aos calores de reação para obter o ⧍H da equação global:
⧍H1/2 + ⧍H2/3 + ⧍H3/6 = (-25)/2 + (-36/3) + 47/6 = -17 kJ/mol
Questão 5

Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório, antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
- A) 293
- B) 345
- C) 414
- D) 690
- E) 828
A alternativa correta é letra D)
Massa de AAS contida em 900.000 comprimidos:
1 comprimido —— 0,5 g
900.000 ———— 450.000 g = 450 kg
1 mol do ácido salicílico —– 1 mol do AAS (100% de rendimento)
1 mol do ácido salicílico —– 0,5 mol do AAS (50% de rendimento)
138 g do ácido salicílico —– 0,5 x 180 g do AAS
x —————– 450 kg
x = 690 kg
Questão 6
Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas condições-padrão, suficiente para acender o LED azul?
- A)

- B)

- C)

- D)

- E)

A alternativa correta é letra C)
A) Uma célula de cério-níquel em série com uma célula de zinco-dicromato.
A ddp da célula de césio-níquel é de E1 = 1,61 - (-0,25) = 2,86 V, sendo o polo positivo no eletrodo de grafite da solução de cério.
A ddp da célula de zinco-dicromato é de E2 = 1,33 - (-0,76) = 2,09 V, sendo o polo positivo no eletrodo de grafite da solução de dicromato.
Desse modo, temos duas pilhas ligadas em série mas com os polos correspondentes juntos. Desse modo, uma delas trabalhará como gerador e a outra como receptor, sendo a ddp resultante igual a E = |E1 - E2| = 0,23 V.
B) Uma célula de cério-zinco em série com uma célula de níquel-cromato.
De modo análogo, calculamos as ddps das duas células:
E1 = 1,61 - (-0,76) = 2,37 V, polo positivo no cério
E2 = 1,33 - (-0,25) = 1,58 V, polo positivo no dicromato
Novamente, temos duas pilhas ligadas em série com os polos correspondentes juntos. Assim, a ddp final será E = |E1 - E2| = 1,29 V
C) Uma célula de cério-zinco em série com uma célula de níquel-cromato.
A diferença entre (c) e (b) é que em (c) os polos opostos estão juntos. Nesse caso, a ddp da associação é a soma das ddps das pilhas: E = E1 + E2 = 3,95 V
D) Uma célula de cério-dicromato e uma de zinco-níquel:
E1 = 1,61 - (1,33) = 0,28 V, polo positivo no cério
E2 = -0,25 - (-0,76) = 0,51 V, polo positivo no níquel
As duas pilhas estão ligadas com os polos opostos juntos, assim a ddp é: E = E1 + E2 = 0,79 V
E) Mesmo caso de (d), mas com os polos de mesmo sinal juntos: E = |E1 - E2| = 0,23 V
7) Alguns tipos de dessalinizadores usam o processo de osmose reversa para obtenção de água potável a partir da água salgada. Nesse método, utiliza-se um recipiente contendo dois compartimentos separados por uma membrana semipermeável: em um deles coloca-se água salgada e no outro recolhe-se a água potável. A aplicação de pressão mecânica no sistema faz a água fluir de um compartimento para o outro. O movimento das moléculas de água através da membrana é controlado pela pressão osmótica e pela pressão mecânica aplicada. Para que ocorra esse processo é necessário que as resultantes das pressões osmótica e mecânica apresentem
- A) mesmo sentido e mesma intensidade.
- B) sentidos opostos e mesma intensidade.
- C) sentidos opostos e maior intensidade da pressão osmótica.
- D) mesmo sentido e maior intensidade da pressão osmótica.
- E) sentidos opostos e maior intensidade da pressão mecânica.
A alternativa correta é letra E)
Gabarito E
A | Inferência incorreta sobre a osmose reversa. Para ocorrer osmose reversa, a pressão mecânica aplicada na solução é maior que a pressão osmótica da água salgada. |
B | Inferência incorreta sobre a osmose reversa. Para ocorrer osmose reversa, a pressão mecânica aplicada na solução é maior que a pressão osmótica da água salgada. |
C | Inferência incorreta sobre a osmose reversa. Para ocorrer osmose reversa, a pressão mecânica aplicada na solução é maior que a pressão osmótica da água salgada. |
D | Inferência incorreta sobre a osmose reversa. Para ocorrer osmose reversa, a pressão mecânica aplicada na solução é maior que a pressão osmótica da água salgada. |
E | Correto. Identificar métodos utilizados em escala industrial para a obtenção de produtos a partir da água do mar: obtenção do cloreto de sódio por evaporação, do gás cloro e do sódio metálico por eletrólise ígnea, do hidróxido de sódio e do gás cloro por eletrólise da salmoura, do carbonato de sódio pelo processo Solvay e de água potável por destilação e por osmose reversa. Reconhecer o processo de autoionização da água pura no nível microscópico como responsável pela condutibilidade elétrica por ela apresentada. |
Questão 8
COSTA. P. R. R. et al. Ácidos e bases em química orgânica.Porto Alegre: Bookman. 2005 (adaptado).

Qual solução deve ser usada para extração do lapachol da serragem do ipê com maior eficiência?
- A) Solução de Na2CO3 para formar um sal de lapachol.
- B) Solução-tampão ácido acético/acetato de sódio (pH = 4,5).
- C) Solução de NaCl a fim de aumentar a forca iônica do meio.
- D) Solução de Na2SO4 para formar um par iônico com lapachol.
- E) Solução de HCI a fim de extrai-lo por meio de reação ácido-base.
A alternativa correta é letra A)
O Lapachol é uma substância de caráter ácido. A solução que deve ser utilizada para extraí-lo deve ter caráter básico, a fim de interagir bem com a molécula ácida. Das alternativas apresentadas, a única que contém uma substância de caráter básico é a letra A, carbonato de sódio.
a) Correta. O Na2CO3 é um sal básico. O íon carbonato (CO32-) é proveniente de um ácido fraco (H2CO3) e pode sofrer hidrólise, aumentando a concentração de íons OH- do meio, o que o caracteriza como sal básico:
CO32- + H2O ⇌ HCO3- + OH-
b) Incorreta. Essa é uma solução ácida (pH < 7).
c) Incorreta. O NaCl é um sal neutro.
d) Incorreta. O Na2SO4 é um sal neutro.
e) Incorreta. Uma solução de HCl tem caráter ácido.
9) As centrífugas são equipamentos utilizados em laboratórios, clínicas e indústrias. Seu funcionamento faz uso da aceleração centrífuga obtida pela rotação de um recipiente e que serve para a separação de sólidos em suspensão em líquidos ou de líquidos misturados entre si.
- A) das diferentes densidades
- B) dos diferentes raios de rotação
- C) das diferentes velocidades angulares
- D) das diferentes quantidades de cada substância
- E) da diferente coesão molecular de cada substância
A alternativa correta é letra A)
Na centrífuga, observa-se o conceito da força de inércia centrífuga:
O módulo da força centrífuga, por ser proporcional à massa do sólido, depende de sua densidade.
Alternativa A.
Questão 10
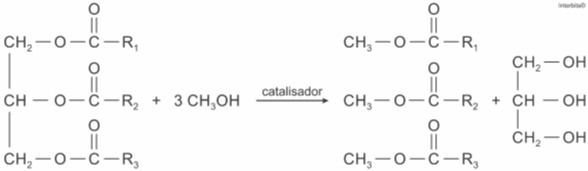
A função química presente no produto que representa o biodiesel é
- A) éter
- B) éster
- C) álcool
- D) cetona
- E) ácido carboxílico
A alternativa correta é letra B)
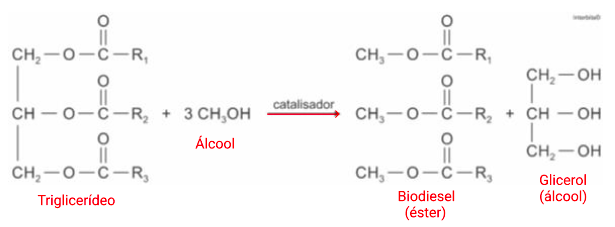
O biodiesel tem origem na reação de triglicerídeos e álcoois. A função bioquímica existente no biodiesel é éster.
Alternativa B.
