Prova de Química do ENEM 2019 Resolvida
Questão 1

Do ponto de vista científico, o que explica o movimento do líquido é a:
- A) evaporação do líquido.
- B) diferença de densidades.
- C) reação química com o papel.
- D) capilaridade nos poros do papel.
- E) resistência ao escoamento do líquido.
A alternativa correta é letra D)
Um líquido pode escoar para cima, contra a gravidade, pela interação intermolecular entre o líquido e a superfície. Isto só pode ocorrer se haver tubos finos pelo qual as moléculas do líquido podem interagir e subir. Esta propriedade é chamada de capilaridade.
2) Um dos parâmetros de controle de qualidade de polpas de frutas destinadas ao consumo como bebida é a acidez total expressa em ácido cítrico, que corresponde à massa dessa substância em 100 gramas de polpa de fruta. O ácido cítrico é uma molécula orgânica que apresenta três hidrogênios ionizáveis (ácido triprótico) e massa molar 192g.mol-1. O quadro indica o valor mínimo desse parâmetro de qualidade para polpas comerciais de algumas frutas.
- A) Apenas caju.
- B) Apenas maracujá.
- C) Caju ou graviola.
- D) Acerola ou cupuaçu.
- E) Cupuaçu ou graviola.
A alternativa correta é letra C)
O número de mols de H+ será igual ao número de mols de OH- adicionado.
Como para cada molécula de ácido cítrico há a liberação de três átomos de H+, o número moléculas de ácido cítrico será o número de mols de H+ dividido por 3.
O número de mols de ácido vezes a massa molar dará a massa de ácido cítrico total. Ao dividirmos este valor pela massa de amostra e multiplicar por 100 teremos a quantidade em massa de ácido cítrico por 100g de polpa.
Como este valor é maior que a acidez mínima para Caju ou Graviola a amostra pode ser de qualquer uma destas frutas.
3) Em 1808, Dalton publicou o seu famoso livro intitulado Um novo sistema de filosofia química (do original A New System of Chemical Philosophy), na qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir:
- A) 1
- B) 2
- C) 3
- D) 4
- E) 5
A alternativa correta é letra E)
A matéria é constituída de átomos indivisíveis. FALSO. O átomo pode ser dividido entre núcleo e eletrosfera.
Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades. FALSO. Existem isótopos que são átomos do mesmo elemento mas possuem diferentes massas.
Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas. FALSO. Existem átomos de elementos diferentes que podem ter a mesma massa, isóbaros.
Os átomos são indestrutíveis e nas reações químicas mantêm suas identidades. FALSO. Os átomos podem ser destruídos e gerar novos átomos de diferentes elementos em processos nucleares.
Átomos de elementos combinam com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos. VERDADEIRO.
Questão 4
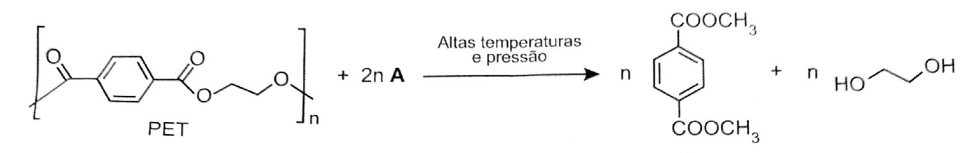
O composto A, representado no esquema de reação é o:
- A) metano.
- B) metanol.
- C) éter metílico.
- D) ácido etanoico.
- E) anidrido etanoico.
A alternativa correta é letra B)
Uma reação de transesterificação ocorre entre um álcool e um éster levando a formação de um novo álcool e um novo éster.

Como há a entrada de um grupo CH3-O-, o composto A seria o metanol CH3OH.
Questão 5

Na conversão de I em II, o “sabonete” atuará com um
- A) ácido.
- B) redutor.
- C) eletrólito.
- D) tensoativo.
- E) catalisador.
A alternativa correta é letra E)
É dito que "a principal vantagem desse “sabonete” é que ele não se desgasta com o uso". Com esta afirmação, podemos afirmar que só pode se tratar de um catalisador que é uma espécie que não é consumida durante a reação.
Questão 6

HAMERSKI, L.; REZENDE, M. J. C.; SILVA, B. V. Usando as cores da natureza para atender aos desejos do consumidor: substâncias naturais como corantes na indústria alimentícia. Revista Virtual de Química, n. 3, 2013.
A propriedade comum às estruturas que confere cor a esses compostos é a presença de:
- A) cadeia conjugada.
- B) cadeia ramificada.
- C) átomos de carbonos terciários.
- D) ligações duplas de configuração cis.
- E) átomos de carbonos de hibridação
A alternativa correta é letra A)
Compostos com a presença de duplas conjugadas apresentam menor energia de excitação entre os orbitais o que faz destes compostos coloridos. Quanto maior o número de duplas conjugadas menor será a diferença de energia entre o orbital molecular mais energético ocupado e o orbital molecular menos energético desocupado.
Questão 7

No funcionamento da bateria, a espécie química formada no ânodo é:
- A) H2(g).
- B) O2(g)
- C) H2O(l).
- D) OH-(aq).
- E) Zn(OH)42-(aq).
A alternativa correta é letra E)
O ânodo é região na qual ocorre a oxidação. Como o Zn metálico foi oxidado a esta seria a espécie formada no ânodo.
Questão 8

Qual das bicamadas lipídicas apresentadas possui maior fluidez?
- A) I
- B) II
- C) III
- D) IV
- E) V
A alternativa correta é letra B)
Como é dito que quanto maior for a magnitude das interações entre os fosfolipídios, menor será a fluidez da membrana a membrana mais fluida será do composto II pois apresenta cadeias insaturadas cis que diminuem a interação intermolecular na camada e cadeias mais curtas que também diminuem a interação garantindo maior fluidez.
9) O concreto utilizado na construção civil é um material formado por cimento misturado a areia, a brita e a água. A areia é normalmente extraída de leitos de rios e brita, oriunda da fragmentação de rochas. Impactos ambientais gerados no uso de concreto estão associados à extração de recursos minerais e ao descarte indiscriminado desse material. Na tentativa de reverter esse quadro, foi proposta a utilização de concreto reciclado moído em substituição ao particulado rochoso graúdo na fabricação de novo concreto, obtendo um material com as mesmas propriedades que o anterior.
- A) extração da brita.
- B) extração da areia.
- C) consumo da água.
- D) consumo do concreto.
- E) fabricação de cimento.
A alternativa correta é letra A)
Quando é dito que foi proposta a utilização de concreto reciclado moído em substituição ao particulado rochoso graúdo na fabricação de novo concreto, deve-se entender que este material particulado graúdo rochoso é a brita. Como há a substituição da brita o benefício ambiental seria a redução da extração de brita.
Questão 10
| Fração | Faixa de temperatura | Exemplos de produtos | Número de átomos de carbono (hidrocarboneto de fórmula geral |
| 1 | Até 20 | Gás natural e gás de cozinha (GLP) | |
| 2 | 30 a 180 | Gasolina | |
| 3 | 170 a 290 | Querosene | |
| 4 | 260 a 350 | Óleo diesel |
SANTA MARIA, L. C. et al. Petróleo: um tema para o ensino de química. Química Nova na Escola, n. 15, maio 2002 (adaptado).
Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas porque
- A) suas densidades são maiores.
- B) o número de ramificações é maior.
- C) sua solubilidade no petróleo é maior.
- D) as forças intermoleculares são mais intensas.
- E) a cadeia carbônica é mais difícil de ser quebrada.
A alternativa correta é letra D)
A) suas densidades são maiores.
INCORRETO. A densidade não irá se relacionar com o aumento ou diminuição da temperatura de ebulição dos compostos.
B) o número de ramificações é maior.
INCORRETO. O exercício não fornece a estrutura das moléculas, apenas a fórmula simplificada.
C) sua solubilidade no petróleo é maior.
INCORRETO. Todos os compostos estão dissolvidos no petróleo e essa propriedade não vai interferir na temperatura de ebulição.
D) as forças intermoleculares são mais intensas.
CORRETO. Quanto maior a cadeia carbônica de um hidrocarboneto, maior será a intensidade da interação intermolecular que ele realiza. Logo, a temperatura necessária para ebulir o composto será maior.
E) a cadeia carbônica é mais difícil de ser quebrada.
INCORRETO. A cadeia carbônica não será quebrada, o que é quebrado é a interação entre as moléculas.
