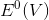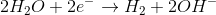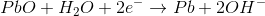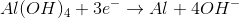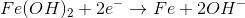Prova de Química do ENEM 2019 Resolvida
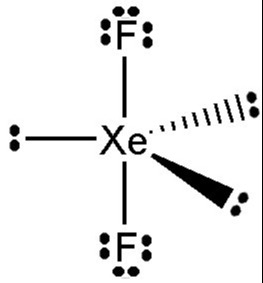
11) Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
- A) 6
- B) 8
- C) 10
- D) 12
- E) 14
A alternativa correta é letra C)
Como o Xe já possui 8 elétrons na camada de valência com a adição de 1 elétron para cada F o Xe terá 10 elétrons na camada de valência.
12) Um teste de laboratório permite identificar alguns cátions metálicos ao introduzir uma pequena quantidade do material de interesse em uma chama de bico de Bunsen para, em seguida, observar a cor da luz emitida.
- A) mudança da fase sólida para a fase líquida do elemento metálico.
- B) combustão dos cátions metálicos provocada pelas moléculas de oxigênio da atmosfera.
- C) diminuição da energia cinética dos elétrons em uma mesma órbita na eletrosfera atômica.
- D) transição eletrônica de um nível mais externo para outro mais interno na eletrosfera atômica.
- E) promoção dos elétrons que se encontram no estado fundamental de energia para níveis mais energéticos.
A alternativa correta é letra D)
O aquecimento no bico de Bunsen promove a excitação de elétrons dos cátions para níveis mais energéticos que ao retornar irão emitir esta energia na forma de luz. Esta propriedade é previsto pelo modelo atômico de Bohr.
Questão 13
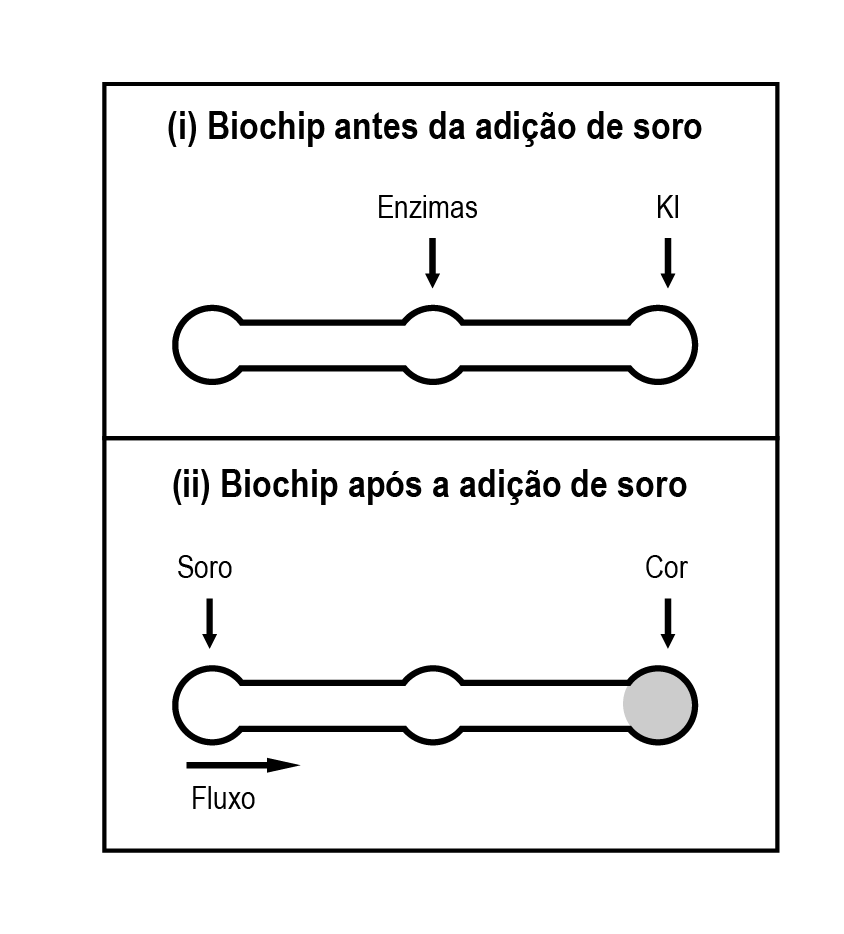
Após a Adição de soro sanguíneo, o fluxo desloca-se espontaneamente da esquerda para a direita (ii) provendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio
EQUAÇÃO 1
Na segunda, o peróxido de hidrogênio reage com íons iodeto gerando íon tri-iodeto, água e oxigênio.
EQUAÇÃO 2
GARCIA, P.T et al. A Handheld Stamping Process to Fabricate Microfluidic Paper-based analytical Devices with Chemically Modified Surface for Clinical Assays. RSC advances, v.4 13 ago.2014 (adaptado).
O tipo de reação que ocorre na superfície do biochip, nas duas reações do processo, é
- A) análise
- B) síntese
- C) oxirredução
- complexação
- E) ácido-base
A alternativa correta é letra C)
Se olharmos apenas para a água oxigenada, H2O2, veremos que o há a formação de água oxigenada na primeira reação a partir de água e a formação de água a partir de água oxigenada na segunda reação. Este processo envolve a mudança do número de oxidação do oxigênio, que é -2 na água e -1 na H2O2. Como há a variação do número de oxidação trata-se de reações de oxirredução.
Questão 14
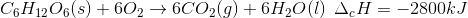
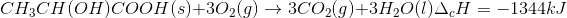
O processo anaeróbico é menos vantajoso energeticamente porque:
- A) libera 112kJ por mol de glicose.
- B) libera 467 kJ por mol de glicose.
- C) libera 2688 kJ por mol de glicose.
- D) absorve 1344kJ por mol de glicose.
- E) absorve 2800kJ por mol de glicose.
A alternativa correta é letra A)
C6H12O6 (glicose)
C3H6O3 (fórmula reduzida do ácido lático)
Pelo enunciado percebemos que é necessário descobrir a entalpia da reação abaixo:
C6H12O6 →2 C3H6O3 ΔH3=?
Para achar essa reação é necessário , somar a entalpia de combustão da glicose com o dobro do inverso da entalpia de combustão do ácido lático, já que:
C6H12O6 + 6O2 → 6CO2 + 6H2O ΔH1= -2800 Kj
6CO2 + 6H2O → 6O2 + C3H6O3 ΔH2 =(2)(-1)(-1344) Kj
Questão 15
Semirreação de redução |
|
| -0,83 |
| -0,73 |
| -0,22 |
| -0,58 |
| -2,33 |
| -0,88 |
Qual é a outra espécie que está presente na composição da mistura sólida comercial para aumentar sua eficiência?
- A) Al
- B) Co
- C) Cu(OH)2
- D) Fe(OH)2
- E) Pb
A alternativa correta é letra A)
Como foi dito no enunciado, ocorre uma reação que faz liberar gás hidrogênio. O gás hidrogênio tem fórmula H2(g) e o seu NOX é igual a 0. Na molécula de água, o hidrogênio tem NOX igual a +1. Sendo assim, houve a redução desse elemento:
2H2O + 2e- → H2 + 2OH- Eºred = - 0,83 V
Já sabemos que o hidrogênio é quem reduz, então é necessário a utilização de um composto que tenha menor potencial de redução do que o hidrogênio para que ocorra a oxidação. Entre as opções apresentadas, 2 compostos apresentam Eºred menor do que o do hidrogênio:
Al(OH)4 + 3e- → Al + 4OH- Eºred = - 2,33 V
Fe(OH)2 + 2e- → Fe + 2OH- Eºred = - 0,88 V
Precisamos do elemento que vá oxidar, então vamos inverter ambas as meias reações:
Al + 4OH- → Al(OH)4 + 3e- Eºoxi = + 2,33 V
Fe + 2OH- → Fe(OH)2 + 2e- Eºoxi = + 0,88 V
Dentre as alternativas, o único composto que irá oxidar melhor que o hidrogênio será o Alumínio puro (Al).