A forma helicoidal de proteínas é estabilizada, geralmente, por ligações entre
- A) S e S.
- B) cadeias laterais.
- C) CO e NH.
- D) moléculas de água.
- E) grupos iônicos.
Resposta:
A alternativa correta é letra C) CO e NH.
Gabarito da banca: Letra "C"
Entendimento: Letra "C"
Acompanhe minha análise:
A imagem mostra claramente a ligação entre CO e NH. Antes, relembre que:
As propriedades físico-químicas e as funções das proteínas têm relação direta com a sua composição em aminoácidos. Por esse motivo, é de extrema importância o conhecimento da sequência com que eles são incorporados à molécula durante a síntese proteica para formar a estrutura tridimensional do polipeptídeo. Didaticamente, a sequência de aminoácidos de uma proteína é denominada estrutura primária da proteína. É bastante comum a utilização do código de três letras ou, com mais frequência, o de uma letra para a apresentação da estrutura primária das proteínas.
Na natureza, uma proteína nativa terá outras interações e ligações além das ligações peptídicas. Essa estrutura tridimensional lhe confere e possibilita a função desempenhada. Assim, as proteínas estruturais são mais fibrilares que as proteínas de reserva ou as enzimas, por exemplo.
O primeiro tipo de interação que ocorre é decorrente da própria ligação peptídica, que possui um caráter de dupla-ligação estendida entre os átomos de oxigênio e nitrogênio.
[...]
Uma [estrutura] bastante comum, denominada α-hélice (Figura 3.17), ocorre quando esses ângulos se situam em valores entre -45 e -60º. Consiste de uma estrutura helicoidal (como o nome salienta) de tal sorte que ocorre uma volta completa sobre um eixo imaginário a cada 3,6-3,7 aminoácidos e cada novo turno da hélice se inicia a cerca de 0,54 a 0,56 nm de distância do anterior. Os grupos R nessa estrutura ficam voltados para o exterior da coluna cilíndrica, formada pelos átomos das ligações peptídicas e pelos Cα. A existência e a estabilidade da α-hélice é dependente, portanto, dos grupos R dos aminoácidos da estrutura primária. Aminoácidos adjacentes com grupos R carregados (como os aa ácidos Asp e Glu e os básicos Arg e Lys) dificultam essa estabilidade, pois tendem a se repelir e alterar os ângulos possíveis para garantir a estrutura. A prolina é outro exemplo de aminoácido que não permite a estrutura em α-hélice pelo fato de possuir grupo R ciclizado com o grupo amino, o que provoca “dobras” na estrutura espacial. O exemplo mais conhecido de proteína em α-hélice é o da α-queratina (presente nos pelos e unhas de mamíferos e nas garras e penas das aves). (p. 25, grifo meu).
A imagem aumenta a sua compreensão (p. 26):
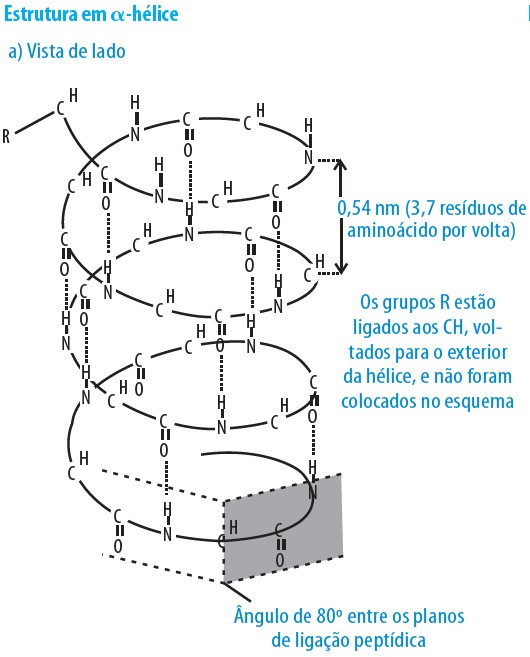
Referência: CARVALHO, H. F.; RECCO-PIMENTEL, S. M. A Célula. 4. ed. Barueri: Manole, 2019.

Deixe um comentário