Continua após a publicidade..
Muitas enzimas possuem um único centroativo para o substrato e seguem a cinética de Michaelis-Menten. As enzimas alostéricas apresentam pelo menos dois centros ativos, sendo um para o substrato e outro para o efetor alóstérico. Normalmente, as enzimas de Michaelis-Menten são monoméricas (estrutura terciária) e as alostéricas são oligoméricas (estrutura quaternária).
Em relação ao gráfico de cinética enzimática abaixo, é CORRETO afirmar que
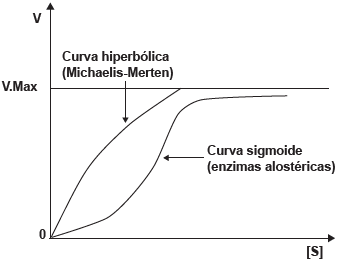
Adaptado de: http://biointeracao.wordpress.com/mecanismo-de-acao-enzimatico/
- A) o gráfico está errado, pois deveria indicar curvas sigmoides também para as enzimas Michaelis-Menten.
- B) a curva sigmoide se adequa apenas às enzimas alostéricas que possuem mais de três sítios catalíticos.
- C) a curva sigmoide só é aplicada a complexos multi-enzimáticos.
- D) a curva sigmoide indica uma atividade cooperativa entre os sítios ativos da enzima alostérica.
Resposta:
A alternativa correta é letra D) a curva sigmoide indica uma atividade cooperativa entre os sítios ativos da enzima alostérica. Enzimas alostéricas possuem múltiplos sítios de ligação, e a ligação de um substrato ou efetor alóstérico em um sítio pode afetar a afinidade de ligação nos outros sítios. Isso resulta em uma cinética não-Michaeliana que pode ser representada por uma curva sigmoide no gráfico de velocidade de reação versus concentração de substrato. A forma sigmoide reflete a transição da enzima entre estados de baixa e alta afinidade pelo substrato, o que é um indicativo de cooperação entre os sítios ativos.

Deixe um comentário