Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
171)
- A) A glicocinase, diferentemente da hexocinase, não é capaz de atuar sobre a glicose.
- B) A hexocinase é inibida por baixos níveis de glicose.
- C) A hexocinase somente atinge a velocidade máxima de reação acima de 20 mmol/L de glicose.
- D) A glicocinase apresenta K m mais elevado que a hexocinase.
- E) A hexocinase sofre desnaturação induzida pela concentração de glicose antes da glicocinase.
Resposta: A alternativa correta é letra D) A glicocinase apresenta Km mais elevado que a hexocinase.
Explicação: As isoenzimas hexocinase e glicocinase são ambas responsáveis pela fosforilação da glicose, um passo inicial no metabolismo da glicose. No entanto, elas diferem em sua afinidade pela glicose, que é representada pelo valor de Km (constante de Michaelis-Menten). Um Km mais elevado indica uma menor afinidade pela glicose, o que significa que são necessárias concentrações mais altas de glicose para que a enzima atinja metade de sua velocidade máxima. A glicocinase, que tem um Km mais alto comparado à hexocinase, é menos sensível a variações nas concentrações de glicose e atua efetivamente em concentrações mais altas, como as encontradas no fígado após uma refeição rica em carboidratos.
172) Um experimento realizado com a enzima hexocinase mostrou que se ela for incubada a 45 oC durante 12 minutos, ela perde cerca de 50% de sua atividade.
- A) a hexocinase exibirá a mesma redução em sua atividade, pois a presença do substrato não altera a conformação da enzima.
- B) a hexocinase ficará mais ativa, pois a presença do substrato contribuirá para expor seu sítio ativo e assim aumentar o poder de catálise.
- C) na presença de seu substrato, o aquecimento a 45ºC aumentará o efeito desnaturante e reduzirá ainda mais a atividade da hexocinase.
- D) como a presença do substrato abaixa a energia de ativação de uma enzima, o tratamento da hexocinase a 45ºC com o substrato só afetará a velocidade da reação.
- E) na presença de concentrações saturantes do substrato, a molécula da enzima se tornará mais estável e o tratamento a 45ºC reduzirá sua atividade discretamente.
A alternativa correta é letra E) na presença de concentrações saturantes do substrato, a molécula da enzima se tornará mais estável e o tratamento a 45ºC reduzirá sua atividade discretamente.
Se a enzima estiver em condições saturantes de substrato ela estará “ligada” ao substrato e será menos sensível às alterações de condições de temperatura.
Essa ligação confere uma maior estabilidade à enzima e sentirá menos o efeito da temperatura (que a pode desnaturar).
Assim, observamos que a alternativa mais condizente com a situação seria a E.
Vamos destacar o erro das demais alternativas.
a) a hexocinase exibirá a mesma redução em sua atividade, pois a presença do substrato não altera a conformação da enzima.
b) a hexocinase ficará mais ativa, pois a presença do substrato contribuirá para expor seu sítio ativo e assim aumentar o poder de catálise.
c) na presença de seu substrato, o aquecimento a 45ºC aumentará o efeito desnaturante e reduzirá ainda mais a atividade da hexocinase.
d) como a presença do substrato abaixa a energia de ativação de uma enzima, o tratamento da hexocinase a 45ºC com o substrato só afetará a velocidade da reação.
Gabarito: E
173) A enzima lisozima tem, em seu sítio ativo, dois aminoácidos essenciais para sua atividade: Glu 35 e Asp 52.
- A) protonado e desprotonado.
- B) desprotonado e protonado.
- C) ambos protonados.
- D) ambos desprotonados.
- E) ambos têm as duas cargas (anfotéricos).
A alternativa correta é letra A) protonado e desprotonado.
O aminoácido pode estar em diferentes formas elétricas dependendo dos grupamentos em sua estrutura, de seu pK e do pH do meio.
Se em pH menor que seu pK o grupamento carboxila estará protonado e se em pH maior que seu pK o grupamento carboxila estará desprotonado.
Assim, em pH = 5,2 o aminoácido Glu35 (pK =5,9) estará protonado e o Asp52 (pK =4,5) estará desprotonado.
Gabarito: A.
174) Observe a tabela a seguir que mostra a correlação entre a concentração de substrato de uma enzima e a sua velocidade de reação.
- A) 1 x 10 –5
- B) 140
- C) 1 x 10 –2
- D) 28
- E) 95
A alternativa correta é letra A) 1 x 10 –5
Pode-se determinar a equação de Michaelis-Menten para determinar o Km desta enzima. Porém, a banca solicita a resolução sem o uso da fórmula.
Sabe-se que quando no =0.5 Vmax, Km=[S]. Então, Km é numericamente igual à concentração do substrato quando a velocidade inicial é igual à metade da sua velocidade máxima.
Sabendo que a Vmáx = 140 e que metade desta velocidade seria Vi = 70, basta buscarmos a concentração do substrato para esta Vi.
Portanto, quando a Vi = 70 observamos que a concentração é 1x10-5. Assim, teremos o Km = 1x10-5.
Gabarito: A
Questão 175
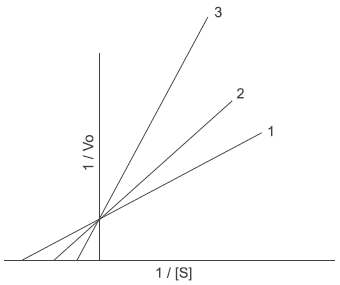
Assinale a alternativa que melhor descreve os resultados expostos no gráfico acima.
- A) Trata-se de inibição não competitiva em que a linha 1 é aquela obtida com a maior concentração do inibidor.
- B) Trata-se de inibição competitiva em que a linha 3 é aquela obtida na ausência do inibidor.
- C) Trata-se de inibição mista na qual a linha 2 é aquela em que o inibidor se encontra na concentração intermediária entre 1 e 3.
- D) Trata-se de inibição mista na qual a linha 3 é aquela obtida na ausência do inibidor.
- E) Trata-se de inibição competitiva na qual a linha 3 é aquela obtida com a maior concentração do inibidor.
A alternativa correta é letra E) Trata-se de inibição competitiva na qual a linha 3 é aquela obtida com a maior concentração do inibidor.
O gráfico acima poderia trazer mais informações, como a não variação da velocidade máxima (todas as linhas cruzam o eixo Y na mesma posição).
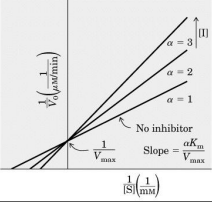
Então, se isto ocorre (V máxima constante) significa que temos um caso de inibição competitiva.
O inibidor compete com o substrato pelo sítio ativo e, portanto, o aumento da concentração do substrato pode deslocar o inibidor. Assim, Vmax não se altera.
Assim em concentrações crescentes de inibidor chegamos às seguintes considerações: Vmax não se altera; o Km aparente aumenta e o slope aumenta.
Portanto, temos esta situação compatível com o gráfico na alternativa E.
Gabarito: E
Questão 176
Observe o gráfico:
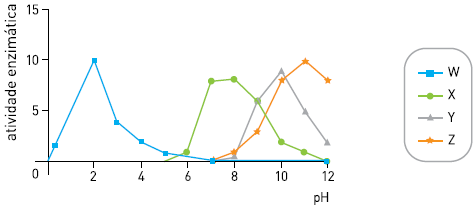
A curva que representa a variação da atividade da quimiotripsina, enzima proteolítica encontrada no suco duodenal, é a identificada pela seguinte letra:
- A) W
- B) X
- C) Y
- D) Z
A alternativa correta é letra B) X
A quimotripsina é uma enzima digestiva sintetizada pelo pâncreas em sua forma inativa, o quimotripsinogênio.
Somente em contato com pH do duodeno, que é básico, o quimotripsinogênio reage com a tripsina, e é convertido em sua forma ativa, a quimotripsina.
No duodeno, o pH em que estas enzimas tem sua ação ótima é por volta de 7,5 - 8,0.
Assim, no gráfico, a linha X apresenta o pico de atividade enzimática no pH referente ao do duodeno, portanto pode-se afirmar que a quimotripsina pode ser representada por X.
A alternativa correta é a letra b) X.
177) Uma vez determinada a estrutura primária de uma proteína enzimaticamente ativa,
- A) os aminoácidos do sítio ativo podem ser identificados positivamente.
- B) a massa molecular da proteína pode ser estabelecida com acurácia.
- C) a temperatura na qual ocorrerá inativação térmica pode ser determinada com acurácia.
- D) é possível calcularmos sua velocidade máxima de reação (Vmax).
A alternativa correta é letra B) - a massa molecular da proteína pode ser estabelecida com acurácia.
Explicação:
A estrutura primária de uma proteína refere-se à sequência linear de aminoácidos, que é determinada pela sequência de nucleotídeos no gene correspondente. Conhecendo a sequência de aminoácidos, é possível calcular a massa molecular da proteína somando as massas moleculares de cada aminoácido individual. Isso é possível porque a massa molecular de cada aminoácido é uma constante conhecida.
As outras opções não são corretas porque:
- A) Identificar positivamente os aminoácidos do sítio ativo requer mais do que a estrutura primária; é necessário conhecer a estrutura tridimensional da proteína.
- C) A temperatura de inativação térmica de uma proteína não pode ser determinada apenas pela estrutura primária, pois depende também de sua estrutura secundária, terciária e quaternária, que influenciam a estabilidade da proteína.
- D) A velocidade máxima de reação (Vmax) de uma enzima não pode ser calculada apenas com base na estrutura primária; é necessário realizar experimentos cinéticos para determiná-la.
178) A regulação metabólica de enzimas é um processo
- A) espontâneo e independente do estado nutricional celular.
- B) com relação citoplasmática reduzida de ATP/ADP.
- C) com responsividade reduzida aos fatores ambientais.
- D) promotor de ativação ou inibição de reações químicas específicas.
A alternativa correta é letra D) promotor de ativação ou inibição de reações químicas específicas.
Explicação:A regulação metabólica de enzimas é um processo essencial para a homeostase celular. Enzimas são proteínas que catalisam reações químicas no corpo, e sua atividade pode ser modulada para responder às necessidades da célula. A alternativa D é correta porque as enzimas são reguladas de maneira que promovem a ativação ou inibição de reações químicas específicas, dependendo de fatores como a disponibilidade de substratos, produtos e sinais regulatórios.
As outras alternativas são incorretas porque:
- A regulação enzimática não é um processo espontâneo; ela requer sinais específicos e frequentemente envolve complexos mecanismos de feedback.
- A relação citoplasmática de ATP/ADP é um indicador do estado energético da célula, mas não é um fator que regula diretamente a atividade enzimática.
- Enzimas são altamente responsivas aos fatores ambientais, como pH e temperatura, que podem afetar sua conformação e atividade.
179) As enzimas participam das reações químicas como
- A) produto.
- B) reagente.
- C) catalisador.
- D) tamponador.
Alternativa C) catalisador.
As enzimas são proteínas especializadas que atuam como catalisadores em reações químicas biológicas. Elas aceleram as reações sem serem consumidas ou alteradas permanentemente no processo. Isso permite que as reações ocorram mais rapidamente e com menos energia do que seria necessário na ausência do catalisador enzimático.
180) A atividade das enzimas pode ser inibida por várias substâncias que atuam de maneira
- A) reversível, acelerando a velocidade das reações químicas.
- B) reversível, promovendo ligações que alteram a estrutura da enzima.
- C) irreversível, promovendo a elevação da eficiência metabólica.
- D) irreversível, ligando-se ao substrato por meio de pontes de hidrogênio.
Alternativa B
Enzimas são proteínas que catalisam reações químicas no corpo, aumentando a velocidade das reações sem serem consumidas no processo. A inibição enzimática reversível ocorre quando uma substância se liga à enzima, reduzindo sua atividade catalítica, mas essa ligação não é permanente. Essas substâncias podem se ligar diretamente ao sítio ativo da enzima ou a um sítio alostérico, que é um local diferente do sítio ativo, mas que ainda induz uma mudança conformacional na enzima que afeta sua atividade.
Essa ligação não covalente pode ser superada pela remoção do inibidor ou por um aumento na concentração do substrato, permitindo que a enzima retome sua função normal. Portanto, a inibição é reversível e pode ser utilizada para regular a atividade enzimática no corpo.
