Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
191) Com relação a proteínas e enzimas, julgue o item subsecutivo.
- A) Certo
- B) Errado
A alternativa correta é letra B) Errado
Gabarito: ERRADA.
A energia livre de Gibbs representa a quantidade de energia capaz de realizar trabalho durante uma reação (temperatura e pressão constantes)1. A variação da energia livre de Gibbs (ΔG) pode ser negativa (reação exergônica) ou positiva (reação endergônicas).
Energia de ativação pode ser entendida como a quantidade de energia necessária para que a reação ocorra, ou seja, a diferença entre os níveis de energia do estado fundamental e do estado de transição1.
As enzimas, por serem catalizadores, aumentam a velocidade da reação diminuindo a energia de ativação, acelerando então a interconversão do substrato em produto. Portanto não diminuem a energia livre de Gibbs.
---
Referências:
1) Nelson, D. L.; Cox, M.M. Lehninger: Princípios de Bioquímica. 3ª edição. São Paulo: Editora Sarvier, 2002. 978p.
192) Em uma das etapas do ciclo de Krebs, a enzima succino desidrogenase catalisa a transformação do ácido succínico em ácido fumárico. A adição de ácido malônico ao sitema provoca a diminuição da taxa da reação que pode ser revertida com o acréscimo de ácido succínico. Fundamentado nos dados acima, é correto afirmar que
- A) o ácido malônico age como co‐enzima.
- B) o ácido malônico age como grupo prostético.
- C) o ácido malônico age aumentando o pH do sistema.
- D) o ácido malônico age inibindo a enzima permanentemente.
- E) o ácido malônico age como inibidor competitivo.
A alternativa correta é letra E) o ácido malônico age como inibidor competitivo.
O ciclo de Krebs, também conhecido como ciclo do ácido cítrico, é uma importante via metabólica na respiração celular, onde ocorre a oxidação completa de moléculas de acetil-CoA, gerando NADH e FADH2, que por sua vez são utilizados na produção de ATP. A succino desidrogenase é uma enzima que participa dessa via, catalisando a reação de transformação do ácido succínico em ácido fumárico.
A adição de ácido malônico ao sistema e sua capacidade de diminuir a taxa da reação, reversível com a adição de ácido succínico, sugere uma interação específica com a enzima succino desidrogenase. A análise das alternativas pode ser feita considerando o papel do ácido malônico nesse contexto.
a) o ácido malônico age como co‐enzima.
INCORRETA: Co-enzimas são moléculas não-proteicas que auxiliam na catalisação de reações enzimáticas, mas não agem diretamente inibindo ou diminuindo a taxa da reação.
b) o ácido malônico age como grupo prostético.
INCORRETA: Grupos prostéticos são componentes não-aminoacídicos permanentemente ligados a uma enzima, enquanto o ácido malônico parece ter uma ação reversível.
c) o ácido malônico age aumentando o pH do sistema.
INCORRETA: Não há evidência de que o ácido malônico atue aumentando o pH do sistema.
d) o ácido malônico age inibindo a enzima permanentemente.
INCORRETA: A reversibilidade da inibição sugere que o ácido malônico não age de forma permanente na enzima.
e) o ácido malônico age como inibidor competitivo.
CORRETA: A descrição do efeito do ácido malônico, diminuindo a taxa da reação e sendo reversível com a adição de ácido succínico, é consistente com a ação de um inibidor competitivo.
193) Apresentam-se a seguir afirmativas sobre enzimas. Preencha com V (Verdadeira) ou F (Falsa), classificando as informações acerca de enzimas:
- A) V – F – V – V – F
- B) F – F – F – V – V
- C) V – V – F – V – V
- D) V – V – V – F – F
A alternativa correta é letra D) V – V – V – F – F.
Explicação:(V) Enzimas aumentam a velocidade das reações e diminuem a energia de ativação. Isso ocorre porque as enzimas atuam como catalisadores biológicos, reduzindo a energia de ativação necessária para que as reações químicas ocorram.
(V) Algumas vantagens das enzimas sobre catalisadores químicos incluem pouca formação de subprodutos e alta especificidade pelo substrato. As enzimas são altamente seletivas, geralmente catalisando reações específicas para determinados substratos.
(V) As enzimas podem agir sobre uma ou várias moléculas de substrato, uma vez que não são consumidas durante as reações. Elas são capazes de catalisar repetidamente as reações sem serem alteradas ou consumidas no processo.
(F) O modelo chave-fechadura não é o mais aceito atualmente. O modelo mais aceito é o de ajuste induzido, que propõe que o sítio ativo da enzima sofre uma mudança conformacional para se ajustar ao substrato.
(F) Existem mais de duas maneiras de atuação dos inibidores enzimáticos. Além da inibição reversível competitiva e da inibição reversível incompetitiva, há também a inibição não competitiva e a inibição irreversível, entre outras.
194) Com relação aos mecanismos de ação, cinética e regulação enzimáticas, assinale a opção correta.
- A) Inibidores de enzimas podem ser reversíveis ou irreversíveis. Os reversíveis podem ainda ser competitivos, quando se ligam
à enzima no mesmo sítio que seria ocupado pelo substrato, ou não competitivos, quando se ligam a um sítio distinto daquele do substrato na enzima.
- B) A atividade de enzimas alostéricas não é afetada por mudanças no pH, apenas por mudança na temperatura.
- C) A Vmax de uma enzima é uma função da formação de produto em determinado período de tempo. Porém, ela não se relaciona com a constante de Michaelis-Menten (km) para uma enzima não alostérica.
- D) Inibidores de enzimas não podem sofrer modificações ao se ligarem à enzima.
- E) Para que uma reação enzimática ocorra, a diferença de energia livre (Delta G) entre o substrato e o produto deve ser negativa e terá valores diferentes para reações catalisadas por enzima ou não.
195) Muitas enzimas são sintetizadas na forma de precussores inativos que só em determinado momento são ativadas pela clivagem de uma ou mais ligações peptídicas específicas. Um exemplo dessas formas inativas é a pró-insulina, que é secretada no pâncreas e se transforma em insulina pela remoção proteolítica de um peptídeo. Esses precussores inativos são conhecidos como:
- A) co-fatores.
- B) isômeros.
- C) coenzimas.
- D) isozimas.
- E) zimogênios.
Resposta: E) zimogênios.
Explicação: Zimogênios, também conhecidos como pró-enzimas, são formas inativas de enzimas que necessitam de uma modificação pós-traducional, como a clivagem de ligações peptídicas específicas, para se tornarem ativas. Esse mecanismo é importante para regular a atividade enzimática no corpo, assegurando que as enzimas sejam ativadas apenas quando necessário. No caso da pró-insulina, ela é convertida em insulina ativa no pâncreas através da remoção de um peptídeo específico, um processo essencial para a regulação dos níveis de glicose no sangue.
196) As enzimas catalisam reações biológicas importantes para o correto funcionamento do organismo e a maioria delas possui em seu centro ativo um metal. Em relação ao mecanismo de catálise enzimática determine a afirmativa correta:
- A) Um catalisador é capaz de alterar a constante de equilíbrio de uma reação química.
- B) O sítio metálico está presente nas enzimas porque metais são necessariamente pouco reativos.
- C) O sítio ativo participa da estrutura do estado de transição, aumentando a energia de ativação da reação.
- D) O sítio ativo está envolvido diretamente na estrutura do estado de transição diminuindo a barreira de reação.
A alternativa correta é letra D) O sítio ativo de uma enzima está diretamente envolvido na estrutura do estado de transição, o que diminui a barreira energética da reação. Isso significa que as enzimas aceleram as reações químicas ao fornecer um caminho alternativo para a reação com uma energia de ativação menor. O sítio ativo forma um complexo com o substrato, estabilizando o estado de transição e, assim, facilitando a conversão do substrato em produto.
Questão 197
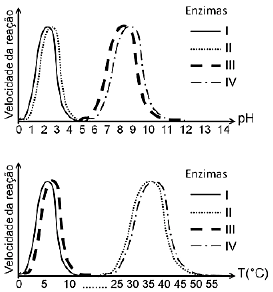
As enzimas provenientes do intestino de peixe e do estômago de ave da Antártida são, respectivamente.
- A) I e II.
- B) I e IV.
- C) III e II.
- D) III e IV.
- E) IV e I.
A alternativa correta é letra C) III e II.
As enzimas III e II apresentam atividades ótimas em temperaturas e pH que são característicos do intestino de peixes e do estômago de aves da Antártida, respectivamente. Isso indica que a enzima III está adaptada para funcionar eficientemente nas condições encontradas no intestino de peixes antárticos, que geralmente têm temperaturas mais baixas e um pH diferente quando comparado a outras regiões. Da mesma forma, a enzima II está adaptada para atuar no estômago de aves antárticas, onde as condições de pH são especialmente ácidas devido à digestão.
198) Sobre o funcionamento das enzimas, considere as seguintes afirmativas:
- A) Somente as afirmativas 1 e 3 são verdadeiras.
- B) Somente as afirmativas 1 e 4 são verdadeiras.
- C) Somente as afirmativas 2 e 4 são verdadeiras.
- D) Somente as afirmativas 2, 3 e 4 são verdadeiras.
- E) As afirmativas 1, 2, 3 e 4 são verdadeiras.
A alternativa correta é letra B) Somente as afirmativas 1 e 4 são verdadeiras.
Gabarito da banca: Letra "B"
Entendimento: Letra "B"
Acompanhe minha análise:
1. As enzimas facilitam a formação do estado de transição nas reações químicas.
CORRETA.
Para compreender o mecanismo da reação [...], precisa-se conhecer um modelo estabelecido para descrever as propriedades físicas das moléculas na reação. Esse modelo é denominado Teoria do Estado de Transição e, a partir dele, foi possível desenvolver o campo da cinética de reações. O modelo postula que a transição entre reagente (estado mais energético) e produto (estado menos energético) ocorre por meio de um estado intermediário, mais energético do que os estados inicial e final, chamado de estado de transição. Nesse ponto, a(s) molécula(s) que reage(m) está(ão) numa condição conhecida como complexo ativado, a partir da qual as moléculas de produto são formadas. A energia necessária para atingir o estado de transição é conhecida como energia de ativação. A velocidade de uma reação é, consequentemente, diretamente proporcional à quantidade de moléculas que atingiram o estado de transição [...].
O mecanismo de funcionamento das enzimas para aumentar a velocidade de reação envolve a redução da energia de ativação necessária para atingir o estado de transição, aumentando a população de moléculas com energia suficiente para serem convertidas em produto.
A ligação entre a enzima e o substrato ocorre numa região específica da molécula da enzima conhecida como sítio ativo, como já discutido no início deste capítulo. Geralmente ele é constituído de uma cavidade na estrutura da enzima, onde as cadeias laterais dos aminoácidos auxiliam na estabilização do substrato e nas reações de catálise. É justamente essa região que confere a grande especificidade das enzimas pelos seus substratos. (40, grifo meu).
2. As enzimas alteram a velocidade e o equilíbrio das reações.
ERRADA. Não alteram o equilíbrio, mas tão somente a velocidade média das reações na célula.
3. A ligação entre substratos e enzimas ocorre por meio de interações fortes.
ERRADA. São ligações fracas, para que as enzimas (catalisadores) sejam restauradas e fiquem aptas a uma nova reação.
4. A velocidade de reação catalisada por uma enzima é limitada pela velocidade de difusão do substrato.
CORRETA. Anote aí (p. 40, grifo meu):
Retomando a equação que descreve a velocidade da reação em função da concentração de substrato, observa-se que, à medida que a reação ocorre, a concentração de substrato diminui. Consequentemente, a velocidade da reação diminui de modo proporcional à concentração de substrato, ou seja, varia com o tempo. Em um intervalo de tempo Δt, pode-se obter a velocidade média da reação. Para isso, é necessário conhecer a velocidade inicial v0, obtida durante o tempo inicial, considerado o intervalo no qual a conversão de substrato em produto tenha sido tão pequena que a concentração de substrato pode ser considerada constante.
Quando se adiciona enzima a uma solução de substrato, ocorre um equilíbrio entre as concentrações de enzima (E), substrato (S) e do complexo enzima-substrato (ES):
E + S ⇌ ES
Quando a quantidade de substrato presente é tão alta que desloca o equilíbrio quase completamente no sentido de formação de ES, praticamente toda a enzima disponível encontra-se complexada com o substrato. Nessas condições, a velocidade de formação do produto é máxima (Vmáx), já que a concentração do reagente nesse caso (ES) é também máxima:
ES ⇌ E + P
Referência: CARVALHO, H. F.; RECCO-PIMENTEL, S. M. A Célula. 4. ed. Barueri: Manole, 2019.
Questão 199
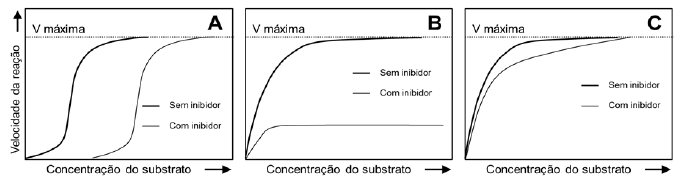
Qual tipo de inibição está ocorrendo em A, B e C, respectivamente?
- A) Alostérica, não competitiva e competitiva.
- B) Alostérica, competitiva e não competitiva.
- C) Competitiva, não competitiva e alostérica.
- D) Competitiva, alostérica e não competitiva.
- E) Não competitiva, competitiva e alostérica.
A alternativa correta é letra A) Alostérica, não competitiva e competitiva.
Explicação:
Na inibição alostérica, um inibidor se liga a um sítio que não é o sítio ativo da enzima, causando uma mudança na conformação da enzima que reduz a afinidade pelo substrato, o que pode ser observado na figura A pela mudança na forma da curva de velocidade em relação à concentração do substrato.
A inibição não competitiva ocorre quando o inibidor se liga tanto à enzima livre quanto ao complexo enzima-substrato, não afetando a afinidade da enzima pelo substrato mas sim a velocidade máxima da reação. Isso é representado na figura B, onde a presença do inibidor diminui a velocidade máxima sem alterar a Km (concentração do substrato na qual a velocidade é metade da Vmax).
Por fim, a inibição competitiva acontece quando o inibidor compete diretamente com o substrato pelo sítio ativo da enzima. Na figura C, a presença do inibidor aumenta a Km (indicando uma menor afinidade pelo substrato na presença do inibidor), mas não altera a Vmax.
200) A ingestão em excesso de alimentos ricos em calorias representa a principal causa de obesidade nas populações humanas. Contudo, a energia gerada para a realização do trabalho celular, e também no corpo humano, depende da atividade das enzimas que participam das reações metabólicas. Sobre este assunto, é correto afirmar que as enzimas:
- A) atuam em baixas concentrações, mas devem ser sintetizadas continuamente pelo hospedeiro, uma vez que perdem sua atividade ao fim das reações químicas que catalisam.
- B) são formadas por compostos que contêm um átomo de carbono (carbono alpha), ao qual se ligam um grupo carboxílico (COOH), um grupo amina (NH2), um radical (R) e um átomo de hidrogênio.
- C) possuem cadeias polipeptídicas formadas por aminoácidos naturais e essenciais, produzidos de forma endógena pelo hospedeiro, tais como a Alanina e a Metionina.
- D) reconhecem de forma específica seus substratos, produzindo uma reação tipo “chave e fechadura”, o que aumenta a energia de ativação necessária às reações metabólicas.
- E) catalisam reações químicas com a mesma eficiência em diferentes faixas de pH e temperatura, somente sendo desnaturadas em temperaturas acima de 100oC.
A alternativa correta é letra B) são formadas por compostos que contêm um átomo de carbono (carbono alpha), ao qual se ligam um grupo carboxílico (COOH), um grupo amina (NH2), um radical (R) e um átomo de hidrogênio.
A alternativa correta é a alternativa B, pois como toda proteína, as enzimas são formadas por aminoácidos. As enzimas contêm um átomo de carbono, ao qual se ligam dois grupos funcionais - um grupo carboxílico (COOH) e um grupo amina (NH2) - e um radical (R) e um átomo de hidrogênio. A estrutura dos aminoácidos é a seguinte:
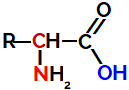
Fonte da figura: DIAS (2022).
a) atuam em baixas concentrações, mas devem ser sintetizadas continuamente pelo hospedeiro, uma vez que perdem sua atividade ao fim das reações químicas que catalisam.
INCORRETA: Após a formação e liberação do produto, novos substratos podem se ligar em uma mesma enzima. As enzimas não são consumidas na reação.
c) possuem cadeias polipeptídicas formadas por aminoácidos naturais e essenciais, produzidos de forma endógena pelo hospedeiro, tais como a Alanina e a Metionina.
INCORRETA: a alanina não essencial.
d) reconhecem de forma específica seus substratos, produzindo uma reação tipo “chave e fechadura”, o que aumenta a energia de ativação necessária às reações metabólicas.
INCORRETA: as enzimas atuam diminuindo a energia de ativação necessária para que determinada reação ocorra.
e) catalisam reações químicas com a mesma eficiência em diferentes faixas de pH e temperatura, somente sendo desnaturadas em temperaturas acima de 100oC.
INCORRETA: A velocidade da reação enzimática vai ser maior ela ocorrer em pH e temperatura ótimos.
FONTE DA FIGURA: DIAS, Diogo Lopes. "O que é aminoácido?"; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-aminoacido.htm. Acesso em 06 de julho de 2022.
