Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
231) A intolerância à lactose consiste em sua má absorção e ocorre quando o indivíduo consome certas quantidades de leite ou de sorvete. Quais sintomas apresenta esse indivíduo após o consumo do alimento?
- A) Febre e diarreia.
- B) Vômito e náuseas.
- C) Flatulência e diarreia.
- D) Cólicas e contrações intestinais.
- E) Sangramento e dores abdominais.
Alternativa C) Flatulência e diarreia.
A intolerância à lactose é uma condição em que o corpo não consegue digerir adequadamente a lactose, um tipo de açúcar presente no leite e em produtos lácteos. Isso ocorre devido à deficiência ou ausência da enzima lactase no intestino delgado. A lactase é responsável por quebrar a lactose em glicose e galactose, que podem ser absorvidas pelo organismo.
Quando uma pessoa com intolerância à lactose consome alimentos que contêm lactose, ela não é devidamente digerida e fermenta no intestino, causando sintomas como flatulência (gases) e diarreia. Esses sintomas ocorrem porque a lactose não digerida atrai água para o intestino (efeito osmótico) e é fermentada pela flora intestinal, produzindo gases e ácidos que contribuem para a diarreia e desconforto abdominal.
Questão 232
Os resultados estão apresentados no gráfico.
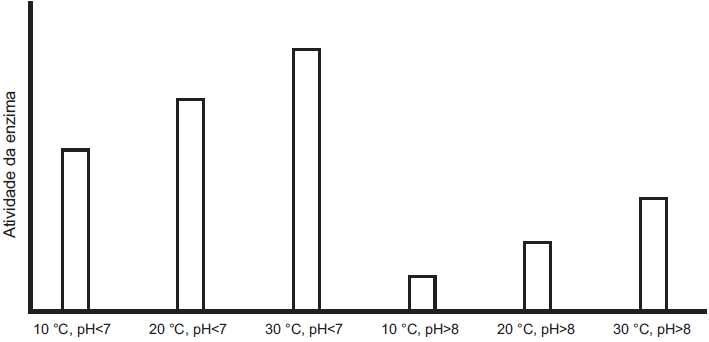
Em relação ao funcionamento da enzima, os resultados obtidos indicam que o(a)
- A) aumento do pH leva a uma atividade maior da enzima.
- B) temperatura baixa (10 ºC) é o principal inibidor da enzima.
- C) ambiente básico reduz a quantidade de enzima necessária na reação.
- D) ambiente básico reduz a quantidade de substrato metabolizado pela enzima.
- E) temperatura ótima de funcionamento da enzima é 30 °C, independentemente do pH.
A alternativa correta é letra D) ambiente básico reduz a quantidade de substrato metabolizado pela enzima.
Gabarito: Letra D.
Conforme o gráfico apresentado, nota-se que a enzima em questão apresenta maior atividade enzimática em dois momentos:
- Quando em pH ácido;
- Quando em um mesmo pH, quanto maior estiver a temperatura.
Com isso, determinam-se as suas condições ótimas:
- pH < 7 e temperatura de 30ºC, conforme apresentadas pela terceira barra do gráfico.
Entretanto, quando comparamos diferentes temperaturas e pH, conforme a primeira e a última barra, verificamos que a atividade enzimática continua sendo maior no pH < 7 (ácido), mesmo a uma temperatura menor (10ºC). Por conseguinte, afirmamos que o principal inibidor desta enzima é o pH > 8 (básico).
Por fim, sabendo-se que as enzimas, que são catalisadoras de reações, atuam por meio de um mecanismo de interação com o substrato ideal, formando o complexo enzima-substrato, podemos afirmar que a quantidade utilizada deste elemento é diretamente proporcional à atividade enzimática.
Com isso, concluímos que o ambiente básico, por ser o principal inibidor da atividade enzimática, reduz, por consequência, a quantidade de substrato metabolizado (utilizado) pela enzima para a formação do complexo.
Com isso, temos o gabarito na Letra D.
233) As enzimas são moléculas orgânicas de natureza proteica que possuem as mais diversas funções nos organismos. Elas catalisam as reações bioquímicas nos seres vivos, sendo, portanto, essenciais para a vida. A velocidade com que essas reações acontecem é afetada pelo pH do meio onde estão. Nesse sentido, considere o gráfico a seguir, representativo de um experimento in vitro, sobre o efeito do pH na velocidade de reação de 3 enzimas digestivas humanas: a pepsina, a ptialina e a tripsina.
- A) I e IV.
- B) II, IV e V.
- C) II, III e V.
- D) I e V.
Resposta: A alternativa correta é letra B) II, IV e V.
As enzimas são proteínas que atuam como catalisadores biológicos, acelerando reações químicas. Cada enzima tem um pH ótimo no qual sua atividade catalítica é máxima. Fora desse pH ótimo, a atividade diminui.
A pepsina, que atua no estômago, tem um pH ótimo bastante ácido, próximo de 2. A ptialina, ou amilase salivar, atua na boca e tem um pH ótimo em torno de 7, que é neutro. Já a tripsina, que atua no intestino delgado, possui um pH ótimo alcalino, em torno de 8.
Portanto, as afirmativas II, IV e V estão corretas, pois refletem o comportamento esperado das enzimas em relação ao pH do meio, influenciando diretamente a velocidade das reações que catalisam.
234) As enzimas são moléculas que contribuem ativamente para a adequada função das células.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
As enzimas são proteínas especializadas que atuam como catalisadores em reações químicas dentro das células. Elas são essenciais para processos como a digestão de alimentos, a síntese de DNA e a produção de energia. A atividade catalítica das enzimas é altamente dependente do pH do meio em que se encontram. Isso ocorre porque o pH pode afetar a estrutura tridimensional da enzima, alterando sua conformação e, consequentemente, sua atividade. Cada enzima tem um pH ótimo no qual sua atividade é máxima. Fora desse intervalo de pH, a atividade enzimática pode diminuir significativamente ou até ser inibida completamente.
235) Em relação às funções que proteínas e enzimas podem desempenhar no organismo, assinale a alternativa correta.
- A) As proteínas regulam as funções hormonais, mas não possuem função estrutural nos organismos.
- B) Actina e Miosina são enzimas que realizam a contração muscular.
- C) Catalisadores são reagentes que participam de reações químicas e as aceleram.
- D) Uma enzima pode participar dos processos de catalisação em vários substratos.
- E) Proteínas e enzimas podem atuar como receptores e transportadores na membrana plasmática.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Gabarito: ANULADA
Analisemos as alternativas acerca das funções das proteínas em geral e das enzimas:
a) As proteínas regulam as funções hormonais, mas não possuem função estrutural nos organismos.
ERRADA: As proteínas desempenham funções estruturais nos organismos. Como exemplo, podemos citar o colágeno e a elastina, proteínas fibrosas que são encontradas na pele, no tecido conectivo, na parede dos vasos sanguíneos e da córnea.
b) Actina e Miosina são enzimas que realizam a contração muscular.
ERRADA: Actina e Miosina são proteínas que realizam a contração muscular, mas não são enzimas, pois não apresentam a função de catalisar reações bioquímicas.
c) Catalisadores são reagentes que participam de reações químicas e as aceleram.
ERRADA: Catalisadores não são reagentes, não sofrem alterações no processo global de reação (não são consumidos no processo), apenas atuam aumentando a velocidade de reação de conversão dos reagentes em produtos.
d) Uma enzima pode participar dos processos de catalisação em vários substratos.
CERTA: Na maioria das reações enzimáticas, duas ou mais moléculas se substratos diversos ligam-se às enzimas durante à catálise. Por exemplo: a reação catalisada pela enzima hexocinase ou hexoquinase, na qual os substratos são o ATP e a glicose:
ATP + glicose → ADP + glicose-6-fosfato
e) Proteínas e enzimas podem atuar como receptores e transportadores na membrana plasmática.
CERTA: Enzimas (proteínas) podem atuar como transportadores na membrana plasmática, podendo ser dos tipos simporte (dois solutos na mesma direção), antiporte (solutos em direções opostas) e uniporte (um tipo de soluto). Ex: Bomba de Na+/K+ (ATPAse de Na+/K+).
Atuando como receptores, podemos citar os receptores tirosina-cinase, os quais desencadeiam sinalização intracelular de crescimento/divisão celular.
Portanto, visto que há duas alternativas corretas (D e E), a banca Instituto AOCP achou por bem a anulação da questão, providência correta e necessária a meu ver.
--
Referências:
1) Alberts, B. et al. Fundamentos da Biologia Celular. 3a Edição. Porto Alegre: Editora Artmed, 2011. 843 p.
2) Nelson, David L.; Cox, Michael M. Princípios de Bioquímica de Lehninger. 6a Edição. Porto Alegre: Editora Artmed, 2014. Editora Artmed. 1250 p.
236) A lactase é uma enzima presente no intestino delgado que converte lactose em galactose e glicose. Algumas pessoas apresentam níveis baixos da enzima lactase e, por isso, podem ter dificuldade em digerir a lactose presente no leite. O diagnóstico dessa deficiência de lactase pode ser feito por meio de exames de sangue: são colhidas amostras de sangue e medidos os níveis de glicemia após 12 horas de jejum e após 30 e 60 minutos da ingestão de lactose dissolvida em água. Nos pacientes com níveis normais de lactase, ocorre aumento da glicemia em 20 mg/dL ou mais em pelo menos um dos intervalos de tempo (30 e 60 minutos). Em pacientes com níveis baixos de lactase, o aumento da glicemia nas duas dosagens após a ingestão de lactose é menor que 20 mg/dL. Considerando a deficiência de lactase e o teste descrito no texto, é correto afirmar:
- A) Devido à deficiência de lactase, a glicose chega inalterada ao intestino grosso, onde é fermentada por bactérias, produzindo gases e ácido láctico.
- B) Um aumento de pelo menos 20 mg/dL na glicemia indica que o paciente tem deficiência de lactase, pois houve acúmulo de lactose no sangue.
- C) Em pacientes com deficiência de lactase, a lactose ofertada no teste é convertida somente em galactose, motivo pelo qual não há aumento da glicemia.
- D) Em pacientes sem deficiência de lactase, um aumento de pelo menos 20 mg/dL na glicemia indica síntese adequada de lactose pela ação da lactase.
- E) Se houver aumento da glicemia maior que 20 mg/dL após a ingestão de lactose, significa que houve conversão adequada da lactose em glicose pela ação da lactase.
A alternativa correta é letra E) Se houver aumento da glicemia maior que 20 mg/dL após a ingestão de lactose, significa que houve conversão adequada da lactose em glicose pela ação da lactase.
Gabarito: Letra E
A lactase é a enzima responsável por hidrolisar a lactose em galactose e glicose, por meio da seguinte reação:
Lactose + H20 → D-galactose + D-glicose
A intolerância à lactose ocorre em adultos devido a perda da atividade da lactase intestinal após a infância. A lactose não digerida vai ao intestino grosso e é convertida em produtos tóxicos pelas bactérias, resultando em diarreias.
Acerca da função da enzima lactase, analisemos as alternativas:
a) Devido à deficiência de lactase, a glicose chega inalterada ao intestino grosso, onde é fermentada por bactérias, produzindo gases e ácido láctico.
ERRADO: A própria lactose chega inalterada ao intestino grosso, não a glicose, como afirma a alternativa.
b) Um aumento de pelo menos 20 mg/dL na glicemia indica que o paciente tem deficiência de lactase, pois houve acúmulo de lactose no sangue.
ERRADO: Nos pacientes com níveis normais de lactase, ocorre aumento da glicemia em 20 mg/dL ou mais em pelo menos um dos intervalos de tempo (30 e 60 minutos). A aumento da glicemia indica atividade em pelo menos 20 mg/dL indica atividade normal da lactase, uma vez que a glicose é produto da ação desta enzima.
c) Em pacientes com deficiência de lactase, a lactose ofertada no teste é convertida somente em galactose, motivo pelo qual não há aumento da glicemia.
ERRADO: Em pacientes com deficiência de lactase, a lactose ofertada no teste não é hidrolisada. Portanto, não haverá aumento dos níveis tanto de glicose como de galactose no sangue, uma vez que ambas são produtos da hidrólise da lactose pela lactase.
d) Em pacientes sem deficiência de lactase, um aumento de pelo menos 20 mg/dL na glicemia indica síntese adequada de lactose pela ação da lactase.
ERRADO: Nos pacientes com níveis normais de lactase (sem deficiência), o aumento da glicemia em 20 mg/dL ou mais indica atividade normal da lactase. Entretanto, a enzima lactase não sintetiza lactose, mas sim a hidrolisa em glicose e galactose.
e) Se houver aumento da glicemia maior que 20 mg/dL após a ingestão de lactose, significa que houve conversão adequada da lactose em glicose pela ação da lactase.
CERTO: O aumento da glicemia em 20 mg/dL ou mais indica atividade normal da lactase, ou seja, há a conversão adequada da lactose em glicose pela ação da lactase.
--
Referências:
1) Nelson, D. L.; Cox, M.M. Princípios de Bioquímica de Lehninger. 6ª Edição. Porto Alegre: Artmed, 2014. 1220p.
Questão 237
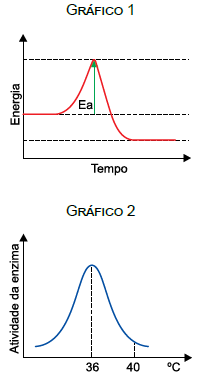
Se essa reação bioquímica ocorrer com a célula mantida a 36 ºC, a energia de ativação (Ea) indicada no gráfico 1 e a velocidade da reação serão, respectivamente,
- A) a mesma e a mesma.
- B) maior e menor.
- C) menor e menor.
- D) menor e maior.
- E) maior e maior.
A alternativa correta é letra D) menor e maior.
Gabarito: Letra D.
d) menor e maior.
A energia de ativação pode ser definida como a energia mínima que é necessária para que uma reação química ocorra. As enzimas são proteínas que funcionam como catalisadoras das reações químicas, em outras palavras, elas fazem com que as reações ocorram mais rapidamente (sem alterar o produto final da reação). A presença de uma enzima na reação diminui a energia de ativação. A atividade enzimática é influenciada por fatores como a temperatura, pH e o tempo de contato com o substrato. Observando o gráfico da atividade enzimática (gráfico 2) apresentando acima, podemos ver que a temperatura ótima para a atividade dessa enzima é 36°C. Quando a célula é mantida a 40°C a enzima está atuando fora da sua temperatura ótima, portanto, é menos eficiente. Quando a célula é mantida a 36°C ocorre um aumento da atividade enzimática, que irá promover a diminuição da energia de ativação.
Questão 238
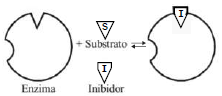
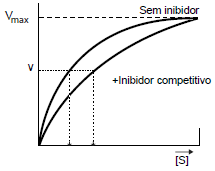
O gráfico demonstra a variação da velocidade de reação em relação à quantidade de substrato presente para os dois complexos mencionados.
MOTTA, Valter T. Bioquímica Básica. e. 2.
Rio de Janeiro: Medbook, 2011, p.36.
Com base nessas informações e nos conhecimentos de bioquímica, é correto afirmar:
- A) O inibidor competitivo reage com a enzima para formar um complexo enzima-inibidor análogo ao complexo enzima-substrato, embora cataliticamente ativo.
- B) Apenas o complexo enzima-substrato poderá alcançar a velocidade máxima, Vmax, de reação devido à ausência do inibidor nesse sistema.
- C) Em altas concentrações de substrato, S, todos os sítios ativos devem estar preenchidos com o substrato, o que justifica a velocidade máxima de reação observada em ambas as curvas no gráfico.
- D) Os inibidores competitivos são moléculas estruturalmente diferentes do substrato, apesar de apresentarem a mesma funcionalidade química.
- E) A ligação do inibidor competitivo com a enzima não bloqueia a ligação do substrato, mas provoca uma modificação da conformação da enzima que evita a formação do produto.
A alternativa correta é letra C) Em altas concentrações de substrato, S, todos os sítios ativos devem estar preenchidos com o substrato, o que justifica a velocidade máxima de reação observada em ambas as curvas no gráfico.
Com base nas informações do enunciado e nos conhecimentos de bioquímica:
a) O inibidor competitivo reage com a enzima para formar um complexo enzima-inibidor análogo ao complexo enzima-substrato, embora cataliticamente ativo.
INCORRETO: O inibidor pode se ligar à enzima livre formando um complexo enzima-inibidor, que é cataliticamente inativo, ou seja, o substrato não vai ser transformado no produto da reação.
b) Apenas o complexo enzima-substrato poderá alcançar a velocidade máxima, Vmax, de reação devido à ausência do inibidor nesse sistema.
INCORRETO: mesmo na presença do inibidor é possível alcançar a Vmax, pois a ação do inibidor pode ser revertida aumentando-se a quantidade de substrato (S) na reação.
c) Em altas concentrações de substrato, S, todos os sítios ativos devem estar preenchidos com o substrato, o que justifica a velocidade máxima de reação observada em ambas as curvas no gráfico.
CORRETO: a ação do inibidor pode ser revertida aumentando-se a quantidade de substrato (S) na reação.
d) Os inibidores competitivos são moléculas estruturalmente diferentes do substrato, apesar de apresentarem a mesma funcionalidade química.
INCORRETO: os inibidorores são moléculas estruturalmente semelhantes ao substrato, mas resistentes à ação da enzima, e competem com o substrato pelo centro ativo da enzima.
e) A ligação do inibidor competitivo com a enzima não bloqueia a ligação do substrato, mas provoca uma modificação da conformação da enzima que evita a formação do produto.
INCORRETO: no caso do inibidor competitivo, ocupa o mesmo sítio de ligação no substrato, impedindo a ligação da enzima. O inibidor alostérico/não competitivo é que provoca uma modificação da conformação da enzima que evita a formação do produto.
239) As proteínas e as enzimas são moléculas orgânicas formadas por aminoácidos, e desempenha diversas funções nos organismos. Sobre essas enzimas, marque a alternativa CORRETA.
- A) Emil Fischer foi quem postulou primeiramente sobre a função das enzimas, o conceito de catálise, mas não havia desvendado ainda o modelo chave-fechadura de correspondência da enzima com o substrato.
- B) As enzimas são capazes de alterar a velocidade da reação decorrente da diminuição da energia de ativação necessária à reação química.
- C) A teoria da catálise considera a reação com equilíbrio em ambos os lados, tanto no substrato quanto no produto. A introdução de um catalisador faz com que a reação acelere, alterando levemente o ponto de equilíbrio, mas sem o consumo do catalisador na reação.
- D) As enzimas são as catalisadoras biológicas, sendo mais eficientes catalisadores que os catalisadores inorgânicos. No entanto muitas enzimas não são especificas e podem atuar mesmo em condições adversas.
Questão 240
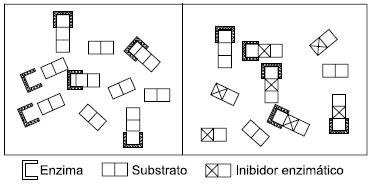
Ao se acrescentar um inibidor por competição a uma solução que contém uma enzima e seu substrato, a catálise enzimática
- A) é totalmente interrompida de forma instantânea.
- B) continua a ocorrer tanto com o substrato quanto com o inibidor.
- C) independe das concentrações de substrato e inibidor.
- D) torna-se menos competitiva.
- E) é acelerada pela concentração do inibidor.
A alternativa correta é letra B) continua a ocorrer tanto com o substrato quanto com o inibidor.
As enzimas são catalizadores de reações do metabolismo humano, agentes químicos que aceleram seletivamente as reações químicas sem alterar o equilíbrio (não são consumidas e nem alteram o produto, apenas a velocidade da reação).
Os inibidores são moléculas estruturalmente semelhantes ao substrato, mas resistentes à ação da enzima, e competem com o substrato pelo centro ativo da enzima. No caso da adição de um inibidor competitivo, este ocupa o mesmo sítio de ligação no substrato, impedindo a ligação da enzima.
Os inibidores diminuem a quantidade de enzimas atuantes, de modo a diminuir a velocidade em relação a reações sem inibidores. No entanto, a catálise enzimática continua a ocorrer tanto com o substrato quanto com o inibidor.
Portanto, gabarito é a alternativa B.
Sobre as demais alternativas:
a) é totalmente interrompida de forma instantânea.
INCORRETA: a catálise não é totalmente interrompida, ocorre uma diminuição da velocidade.
c) independe das concentrações de substrato e inibidor.
INCORRETA: a concentração de substrato e inibidor influenciam na catálise enzimática - aumento de substrato pode compensar a presença de inibidores, por exemplo.
d) torna-se menos competitiva.
INCORRETA: o inibidor aumenta a competição com enzimas pelo substrato.
e) é acelerada pela concentração do inibidor.
INCORRETA: a velocidade da catálise enzimática será inversamente proporcional à concentração do inibidor, considerando quantidades constantes de substrato e enzima.
